Содержание
- 2. Русский язык Химический язык Буквы (33) Знаки химических элементов Слова Химические формулы Предложения Уравнения химических реакций
- 3. Состав веществ выражают химическими формулами Вещества по качественному составу делятся на простые и сложные. Простые вещества
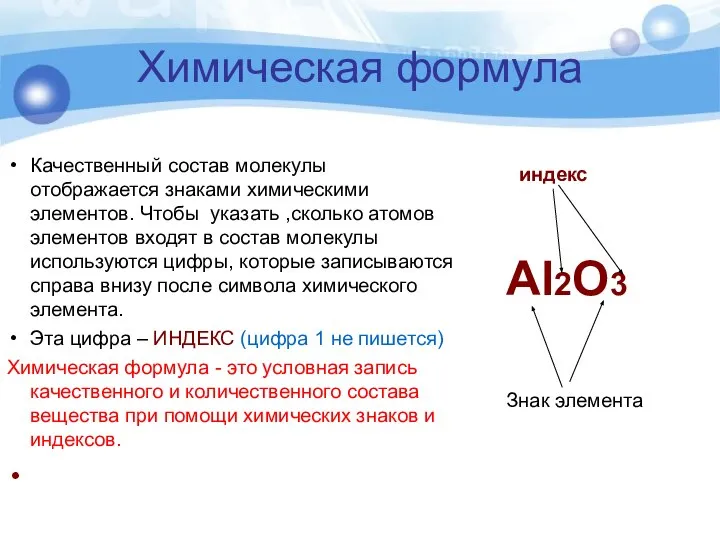
- 4. Химическая формула Качественный состав молекулы отображается знаками химическими элементов. Чтобы указать ,сколько атомов элементов входят в
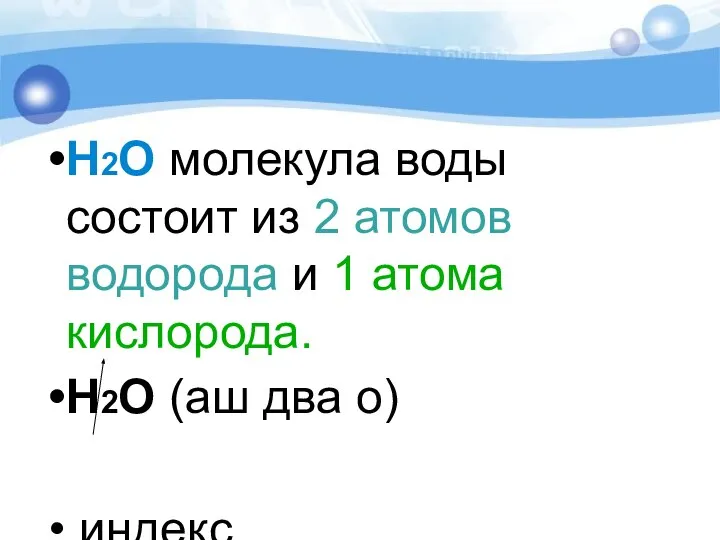
- 5. Н2О молекула воды состоит из 2 атомов водорода и 1 атома кислорода. Н2О (аш два о)
- 6. Прочитайте (произнесите) формулы: SiO2 (силициум о два) CO2 (це о два) HCl (аш хлор) 4Н2О –
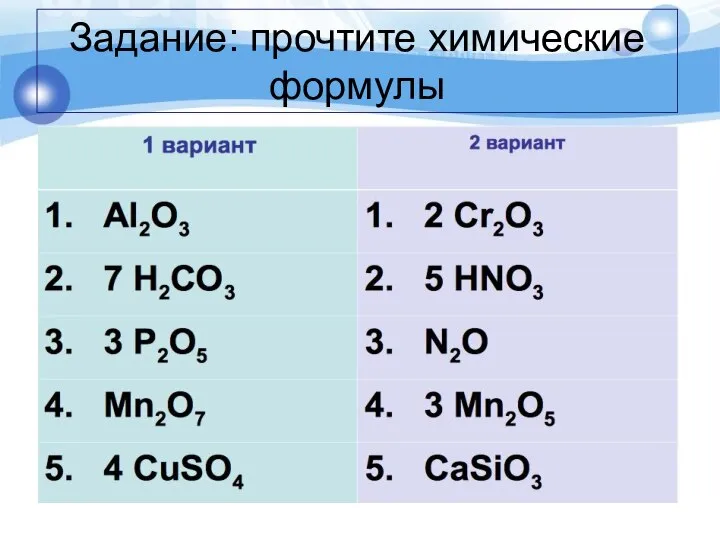
- 7. Задание: прочтите химические формулы
- 8. Относительная атомная масса Пользоваться такими малыми значениями неудобно, поэтому введено понятие об относительной атомной массе Аr
- 9. Относительная атомная масса Масса молекул и атомов очень мала, поэтому ими неудобно, да и невозможно пользоваться.
- 10. Аr - относительная атомная масс элемента А- атомная масс элемента Аr (О) =2,66*10-23 г./1,66*10-24г.=16 А(о)=16 а.е.м.
- 11. Относительная молекулярная масса - Мr Значения относительной молекулярной массы рассчитываются из значений относительной атомной массы с
- 12. Относительная молекулярная масса - Мr Установлено, что молекула N2 Mr (N2) = 2*14 = 28, молекула
- 13. Массовая доля элемента в веществе Определяется по формуле: ω(Э)= где ω(Э) – массовая доля элемента Э
- 14. Массовая доля элемента в сложном веществе Например, для воды H2O wH = 0,11 (11%) и wO
- 15. Закрепление: Назовите новые понятия, с которыми вы познакомились на уроке. Что означают записи: 3F2, F2, 10F
- 16. Домашнее задание
- 18. Скачать презентацию











 Отрасли химии
Отрасли химии Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Химическая промышленность
Химическая промышленность Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода Металлы. Свойства металлов
Металлы. Свойства металлов Классификация органических веществ
Классификация органических веществ Аймақтық мета морфизм тауж ыныстары
Аймақтық мета морфизм тауж ыныстары Блеск и сила волос с точки зрения химии
Блеск и сила волос с точки зрения химии Роль нитрадов. Взгляд специалистов
Роль нитрадов. Взгляд специалистов Химические свойства кислот. 11 класс
Химические свойства кислот. 11 класс Непредельные карбоновые кислоты
Непредельные карбоновые кислоты Полимеры
Полимеры Презентация на тему Производство серной кислоты
Презентация на тему Производство серной кислоты  proverochnaya_zadachi_1_ball_-_kopia (1)
proverochnaya_zadachi_1_ball_-_kopia (1) Методы защиты металлов от электрохимической коррозии. Классификация методов защиты
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты Азотсодержащие соединения. (Лекция 13)
Азотсодержащие соединения. (Лекция 13) Химическая география чудес
Химическая география чудес Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс)  Консультация по химии
Консультация по химии Роль химии в Великой Отечественной войне
Роль химии в Великой Отечественной войне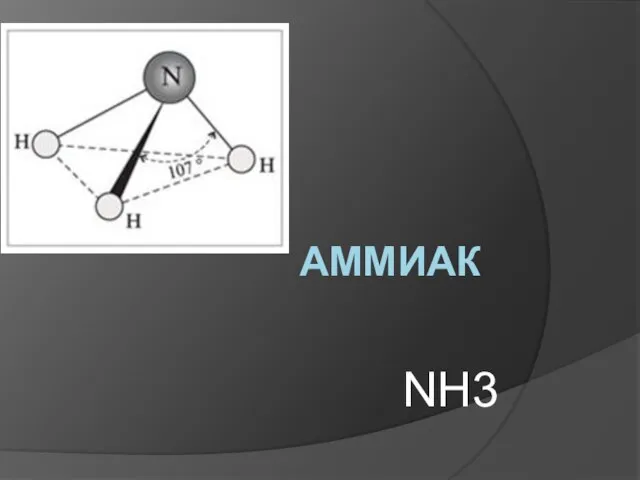 Аммиак NH3
Аммиак NH3 Эмпирические правила
Эмпирические правила Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол
Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол Пути использования активной уксусной кислоты
Пути использования активной уксусной кислоты Что такое эксперимент?
Что такое эксперимент? Вуглеводи
Вуглеводи