Содержание
- 2. Серная кислота H2SO4 cуществует в природе как самостоятельное химическое соединение, представляет собой бесцветную маслянистую жидкость без
- 3. VIII век – арабский алхимик Аджабир ибн Хайян получил «кислые газы» из «зеленого камня» (железного купороса).
- 4. Исходное сырье Сырьё – исходный материал для производства промышленных продуктов. В мире 75% получают из серы.
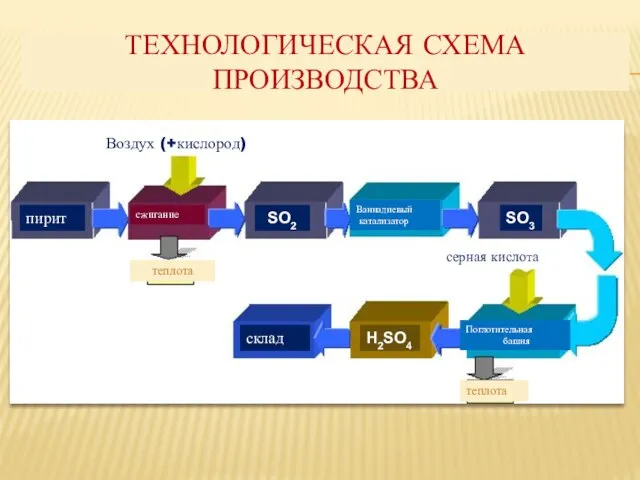
- 5. Технологическая схема производства пирит сжигание Ваннадиевый катализатор Поглотительная башня серная кислота теплота Воздух (+кислород) теплота склад
- 6. Технология – наука о наиболее экологичных способах и процессах получения сырья, полупродуктов и продуктов. I стадия
- 7. Печь для обжига в «кипящем» слое
- 8. Оптимальные условия I стадии Воздух, обогащенный кислородом. t=8000 , теплота экзотермической реакции отводиться. «Кипящий» слой (увеличение
- 9. Принципы производства I стадии (печь для обжига с «кипящим» слоем) 1. «Кипящий» слой. 2. Большая мощность.
- 10. Подготовка сырья для II стадии (циклон, электрофильтр, сушильная башня) Прежде чем приступить ко II стадии SO2
- 11. Циклон и электрофильтр (принцип действия – центробежная сила, притяжение заряженных частиц)
- 12. Сушильная башня (принцип действия – поглощение воды концентрированной серной кислотой)
- 13. Принципы II стадии (контактный аппарат) 2 SO2 + O2 ↔ 2 SO3 + Q (обратимая, каталитическая,
- 14. Контактный аппарат
- 15. III Стадия (поглотительная башня) SO3+H2O=H2SO4+Q (до 3000C) Увеличивают площадь соприкосновения (керамические кольца Рашига) Отводят продукты реакции
- 16. Поглотительная башня
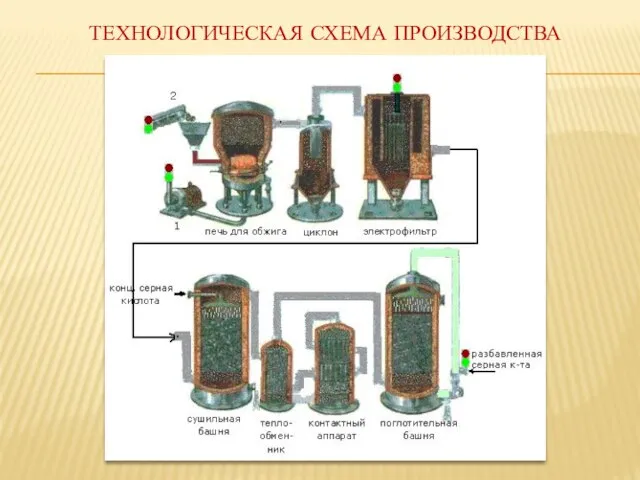
- 17. Технологическая схема производства
- 18. Транспортировка и хранение серной кислоты Транспортируют в железнодорожных и автоцистернах из кислотостойкой стали Хранят в герметически
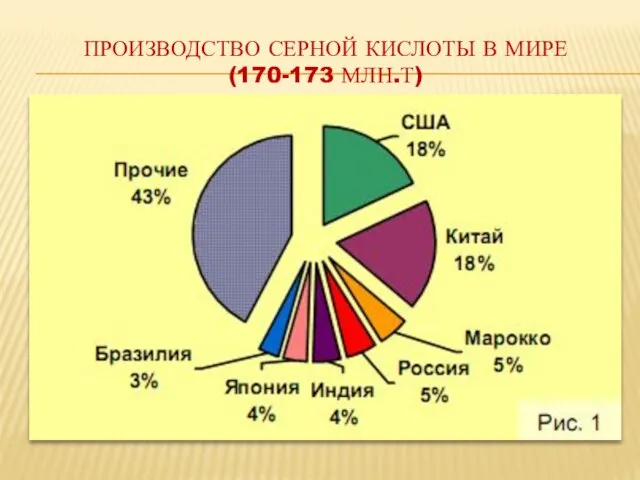
- 19. ПРОизводство серной кислоты в мире (170-173 млн.т)
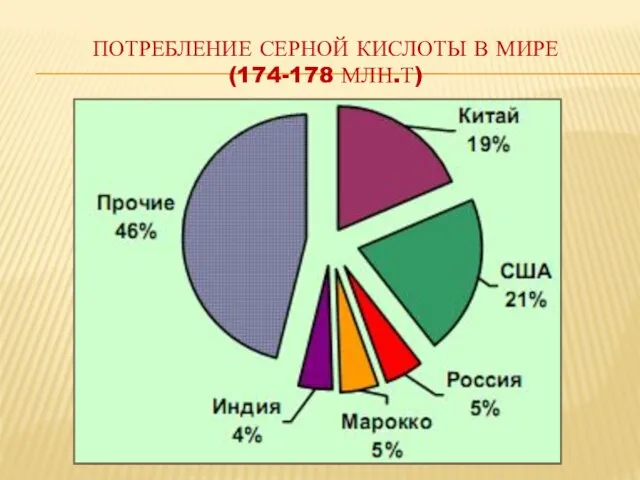
- 20. Потребление серной кислоты в мире (174-178 млн.т)
- 21. потребление серной кислоты 1. Производство минеральных удобрений. 2. Производство сульфатов (солей серной кислоты). 3. Производство синтетических
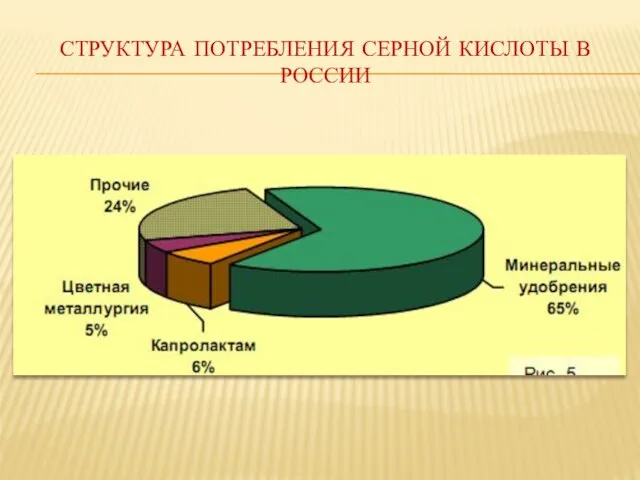
- 22. Структура потребления серной кислоты в России
- 24. Скачать презентацию
















 Электролиз (катод)
Электролиз (катод) Химия элементов IVA группы
Химия элементов IVA группы Деформация аморфных и кристаллических полимеров
Деформация аморфных и кристаллических полимеров Диссоциация кислот
Диссоциация кислот Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях восстановление карбонильных соединений, кетены, поликарбонилы
восстановление карбонильных соединений, кетены, поликарбонилы Её величество – вода Интегрированный урок химии в 8 классе
Её величество – вода Интегрированный урок химии в 8 классе Презентация на тему Каучук
Презентация на тему Каучук  Аналитическая химия. Гомогенные растворы
Аналитическая химия. Гомогенные растворы Степень окисления
Степень окисления Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Алкены
Алкены Нуклеиновые кислоты
Нуклеиновые кислоты Тренажер. Типы химических реакций
Тренажер. Типы химических реакций Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Дисперсные системы. Тест
Дисперсные системы. Тест Производство аммиака
Производство аммиака Проектная работа Кристаллизация
Проектная работа Кристаллизация proverochnaya_zadachi_1_ball_-_kopia (1)
proverochnaya_zadachi_1_ball_-_kopia (1) Этиленовые углеводороды
Этиленовые углеводороды Основания. Щелочи – растворимые основания
Основания. Щелочи – растворимые основания Реакции ионного обмена
Реакции ионного обмена Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Природные кристаллы
Природные кристаллы Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Методы изготовления из резины и латекса
Методы изготовления из резины и латекса Урок-путешествие по теме «Первоначальные химические понятия»
Урок-путешествие по теме «Первоначальные химические понятия» Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)
Получение галогенов. Биологическое значение и применение галогенов и их соединений. (1)