Содержание
- 2. Проводят ли электрический ток вода, соль и раствор соли?
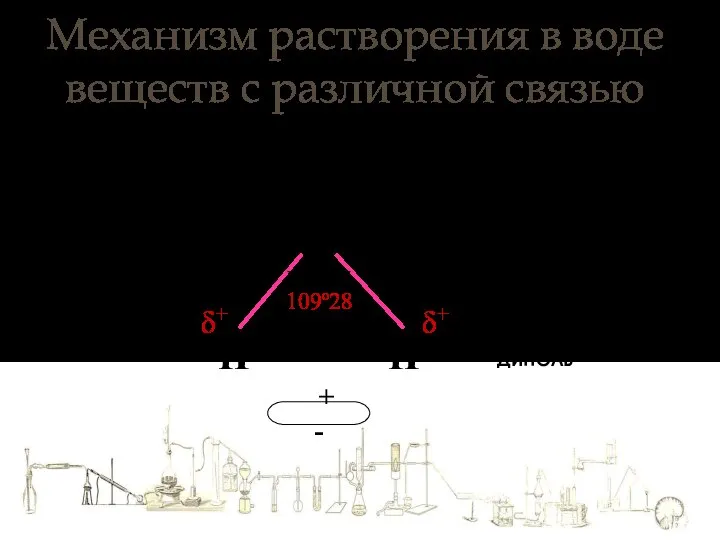
- 3. Механизм растворения в воде веществ с различной связью О Н Н 109º28 + - δ+ δ+
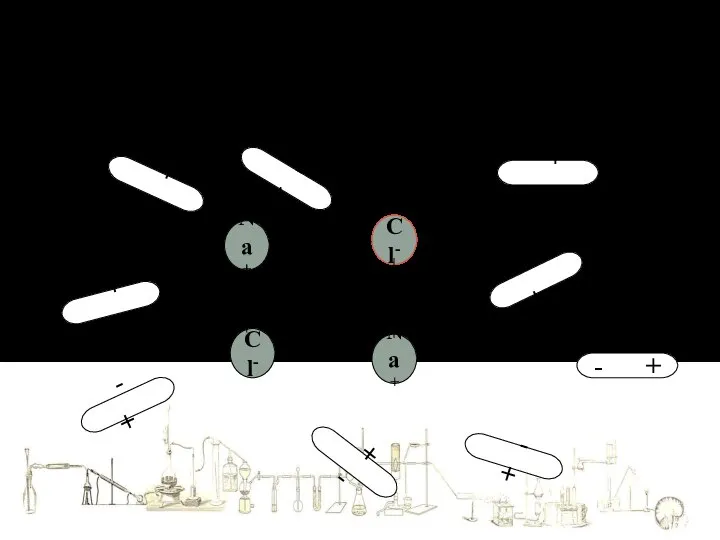
- 4. Механизм растворения в воде веществ с ИОННОЙ связью Na+ Cl- Cl- Na+ + - + -
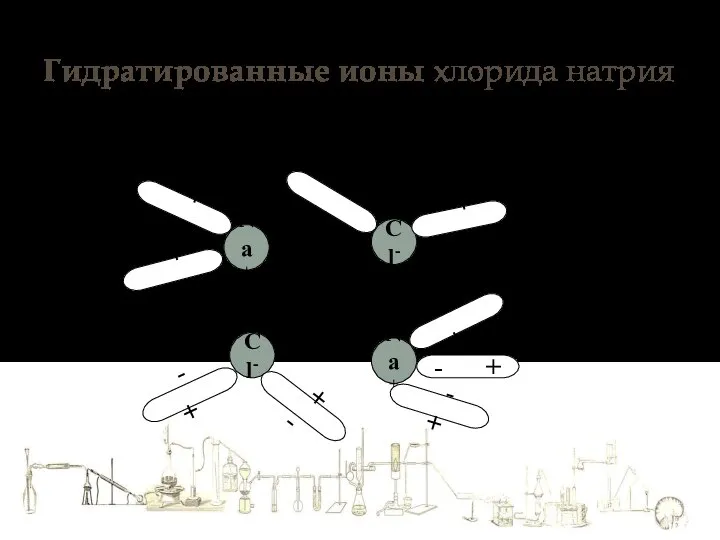
- 5. Гидратированные ионы хлорида натрия Na+ Cl- Cl- Na+ + - + - + - - +
- 6. Механизм растворения в воде веществ с ИОННОЙ связью Процессу гидратации способствует большая диэлектрическая проницаемость воды. При
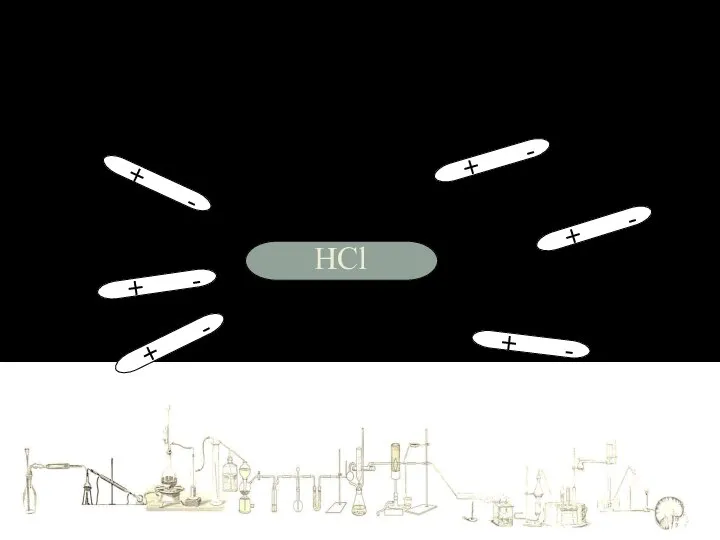
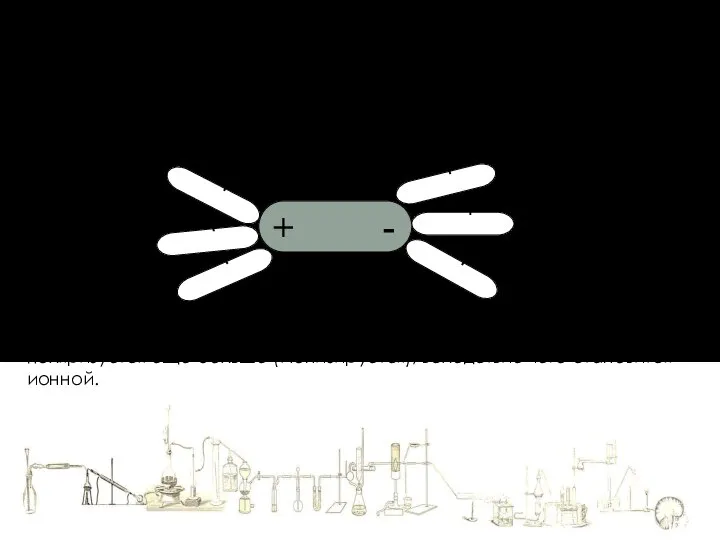
- 7. + - + - + - + - + - + - HCl Механизм растворения в
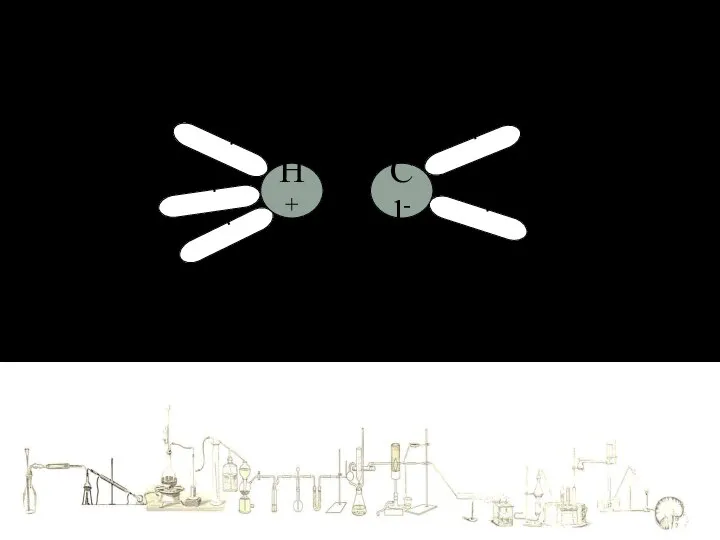
- 8. Механизм растворения в воде веществ с КОВАЛЕНТНОЙ ПОЛЯРНОЙ связью + - + - + - +
- 9. + - + - + - + - + - H+ Cl- Гидратированные ионы
- 10. Соли и щелочи проводят ток не только в растворах, но и в расплавах. А сахар, ацетон
- 11. Электролиты - вещества, водные растворы и расплавы которых проводят электрический ток В приборе - раствор электролита
- 12. Неэлектролиты - вещества, водные растворы и расплавы которых НЕ проводят электрический ток В приборе – раствор
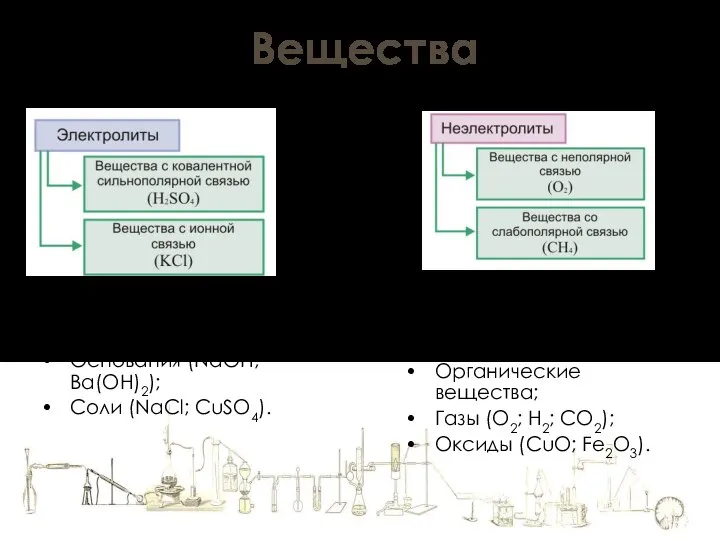
- 13. Вещества (проводят электрический ток) Кислоты (HCl; H2SO4); Основания (NaOH; Ba(OH)2); Соли (NaCl; CuSO4). (не проводят электрический
- 14. Электролитическая диссоциация - процесс распада электролита на ионы при растворении в воде или расплавлении. Сванте Август
- 15. Теория электролитической диссоциации 1. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на положительно заряженные
- 16. Теория электролитической диссоциации Уравнение диссоциации записывают упрощенно KCl → K+ + Cl- 1. Электролиты при растворении
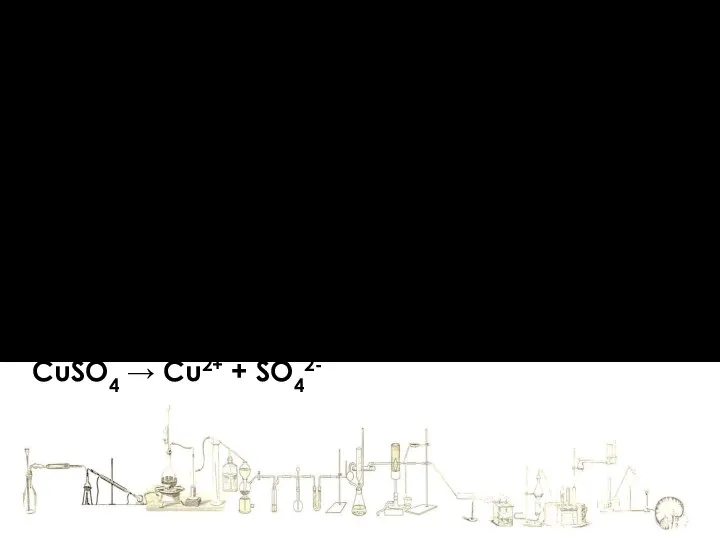
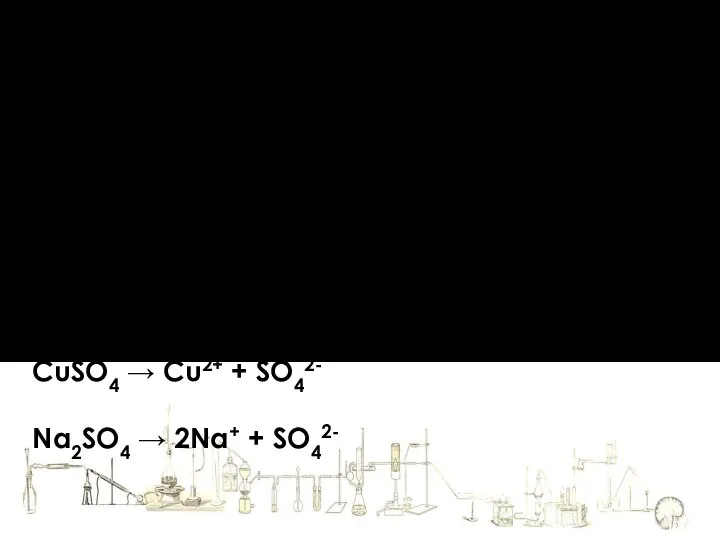
- 17. Теория электролитической диссоциации Уравнение диссоциации записывают упрощенно KCl → K+ + Cl- CuSO4 → Cu2+ +
- 18. Теория электролитической диссоциации Уравнение диссоциации записывают упрощенно KCl → K+ + Cl- CuSO4 → Cu2+ +
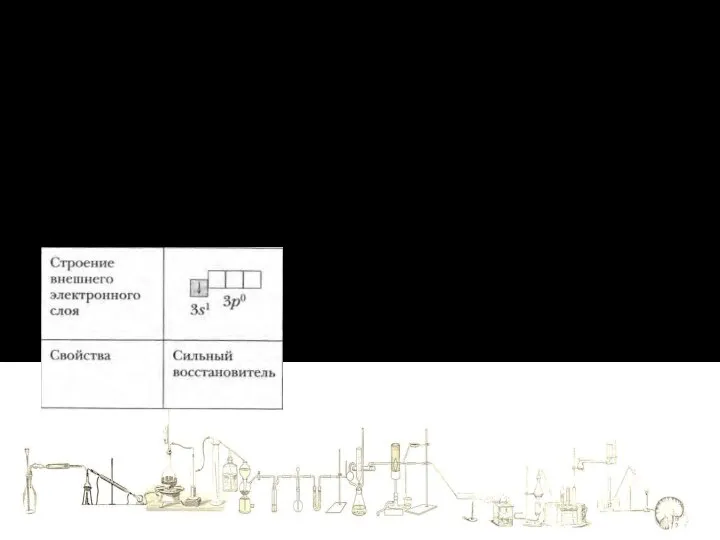
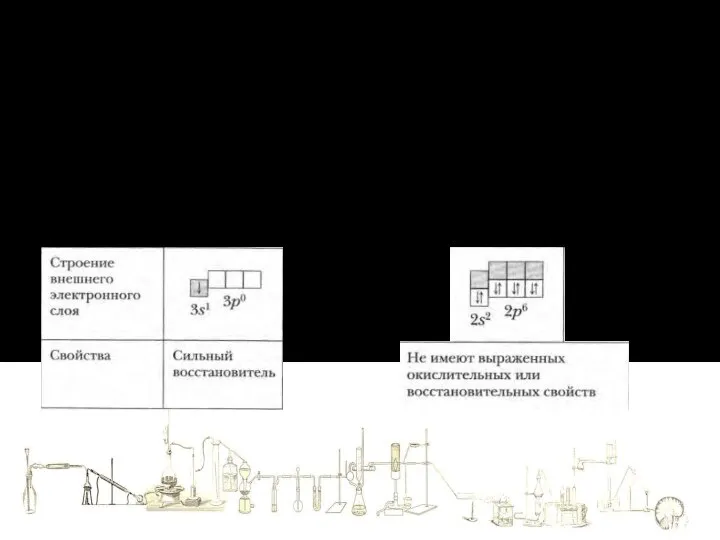
- 19. Теория электролитической диссоциации 2. Ионы отличаются от атомов по строению и свойствам. Ионы находятся в более
- 20. Теория электролитической диссоциации 2. Ионы отличаются от атомов по строению и свойствам. Ионы находятся в более
- 21. Теория электролитической диссоциации 2. Ионы отличаются от атомов по строению и свойствам. Ионы находятся в более
- 22. Теория электролитической диссоциации 3. В растворах и расплавах электролиты проводят электрический ток. При пропускании тока ионы
- 23. Растворение – физико-химический процесс При растворение в воде серной кислоты выделяется большое количество тепла. При растворении
- 24. Гидратированные ионы могут отличаться по окраске от негидратированных CuSO4 – белый порошок Гидратированные ионы меди придают
- 26. Скачать презентацию












 Классификация органических соединений и реакций. Изомерия. Лекция 2
Классификация органических соединений и реакций. Изомерия. Лекция 2 Проектная работа Кристаллизация
Проектная работа Кристаллизация Присоединение аммиака и аминов
Присоединение аммиака и аминов Основы химической кинетики
Основы химической кинетики Мыльная история
Мыльная история Общая характеристика аргона
Общая характеристика аргона Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Красители vs пигменты
Красители vs пигменты Химическая связь. Лекция №3
Химическая связь. Лекция №3 Химические равновесия в растворах. Лекция 2. Часть 1
Химические равновесия в растворах. Лекция 2. Часть 1 Потенциометрический анализ, титрование
Потенциометрический анализ, титрование Сложные реакции
Сложные реакции Основания. Растворимые (гидроксиды щелочных и щелочноземельных металлов). Нерастворимые
Основания. Растворимые (гидроксиды щелочных и щелочноземельных металлов). Нерастворимые Презентация на тему Арены (10 класс)
Презентация на тему Арены (10 класс)  Презентация на тему Химия и здоровье человека (10 класс)
Презентация на тему Химия и здоровье человека (10 класс)  Шаблон для презентации по химии
Шаблон для презентации по химии Презентация на тему Все о спиртах
Презентация на тему Все о спиртах  Альдегиды. Состав. Строение. Свойства. Применение
Альдегиды. Состав. Строение. Свойства. Применение Ортофосфорная кислота
Ортофосфорная кислота Степень окисления
Степень окисления Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Валентность. Нахождение химической формулы вещества по валентности
Валентность. Нахождение химической формулы вещества по валентности Соли
Соли Vzácne plyny
Vzácne plyny Полезные ископаемые
Полезные ископаемые Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Введение в медицинскую химию: от молекулы к лекарству
Введение в медицинскую химию: от молекулы к лекарству Күкірт қышқылын алудың контакт әдісі
Күкірт қышқылын алудың контакт әдісі