Содержание
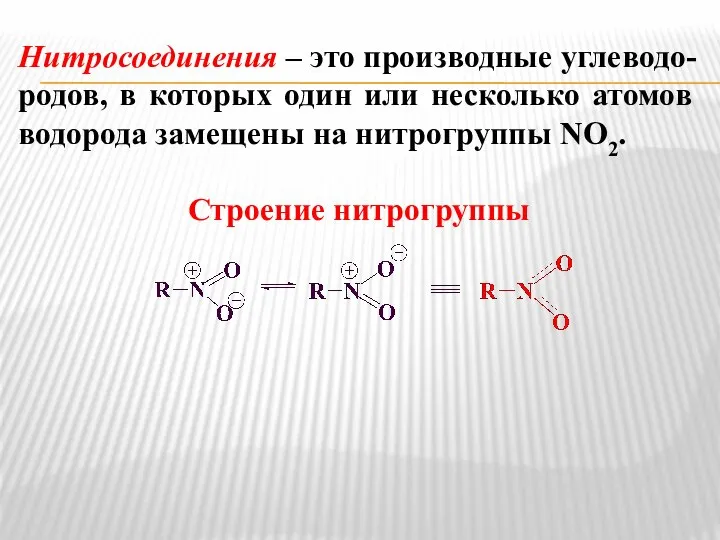
- 2. Нитросоединения – это производные углеводо-родов, в которых один или несколько атомов водорода замещены на нитрогруппы NO2.
- 3. Способы получения нитросоединений Нитрование алканов Нитрование аренов Взаимодействие галогеналканов с нитритами (нуклеофильное замещение) Окисление первичных аминов
- 4. Первичные и вторичные нитросоединения являются СН-кислотами и в растворах щелочей образуют соли – нитронаты, которые при
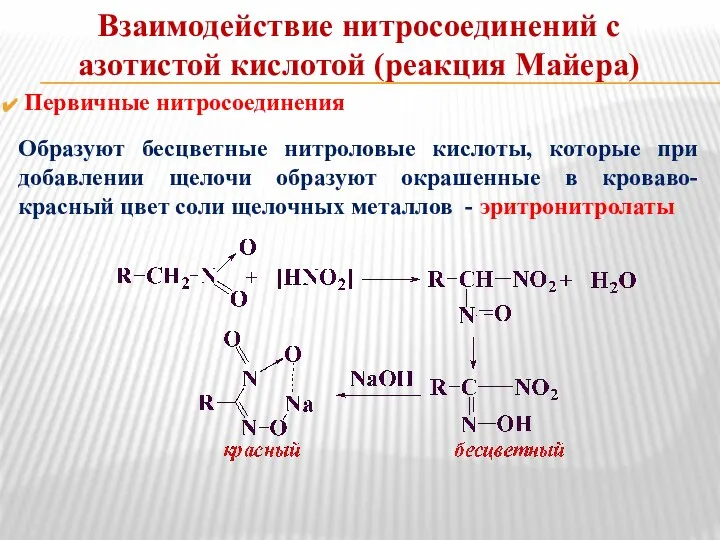
- 5. Первичные нитросоединения Образуют бесцветные нитроловые кислоты, которые при добавлении щелочи образуют окрашенные в кроваво-красный цвет соли
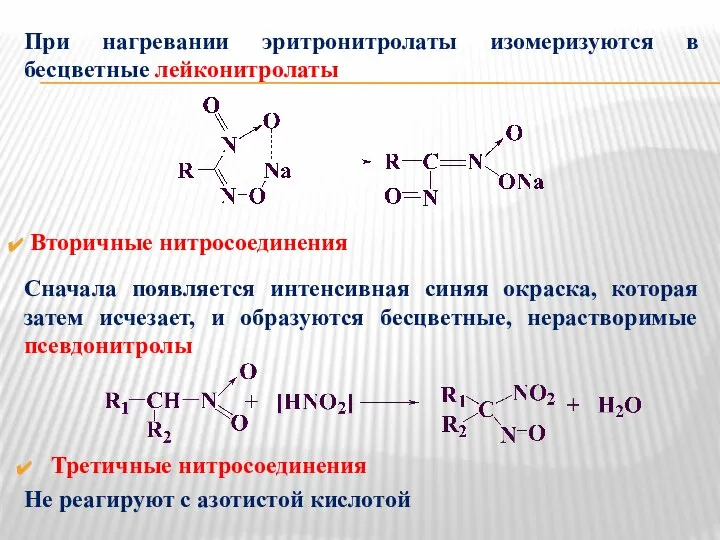
- 6. При нагревании эритронитролаты изомеризуются в бесцветные лейконитролаты Вторичные нитросоединения Сначала появляется интенсивная синяя окраска, которая затем
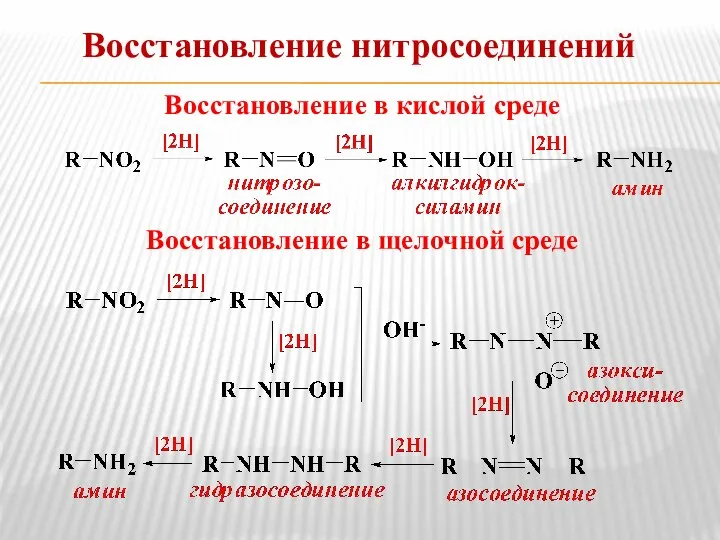
- 7. Восстановление в кислой среде Восстановление в щелочной среде Восстановление нитросоединений
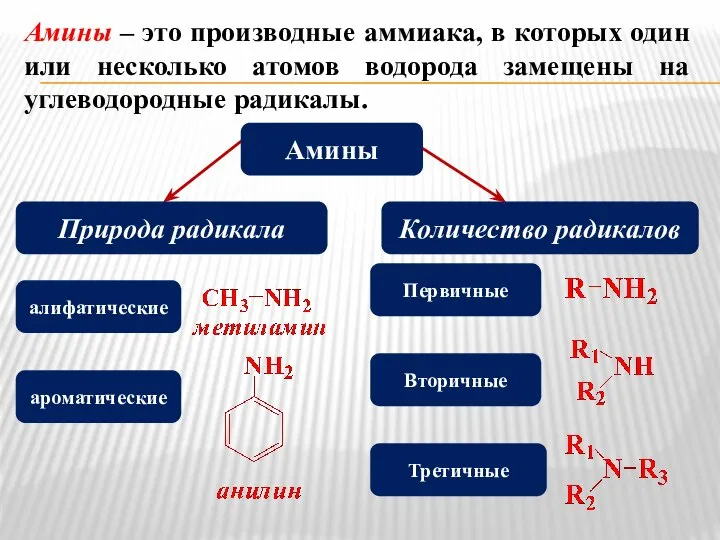
- 8. Амины – это производные аммиака, в которых один или несколько атомов водорода замещены на углеводородные радикалы.
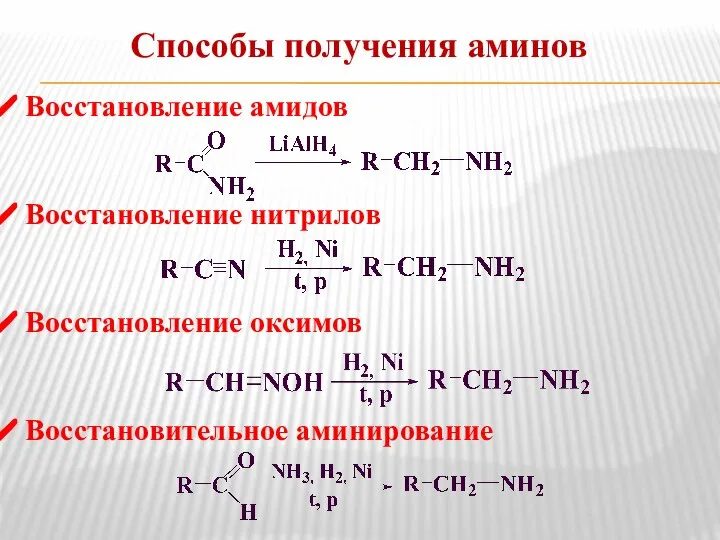
- 9. Способы получения аминов Восстановление амидов Восстановление нитрилов Восстановление оксимов Восстановительное аминирование
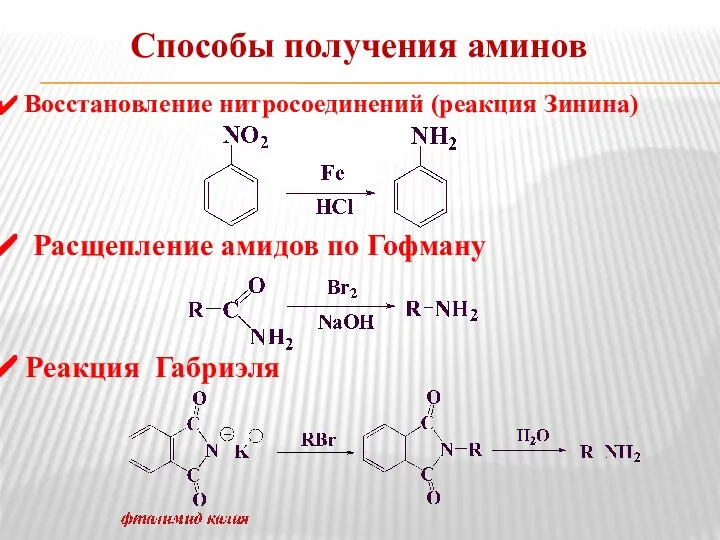
- 10. Способы получения аминов Восстановление нитросоединений (реакция Зинина) Расщепление амидов по Гофману Реакция Габриэля
- 11. Способы получения аминов Алкилирование аммиака
- 12. Реакционные центры в аминах NН-кислотный центр n-Основный и нуклеофильный центры
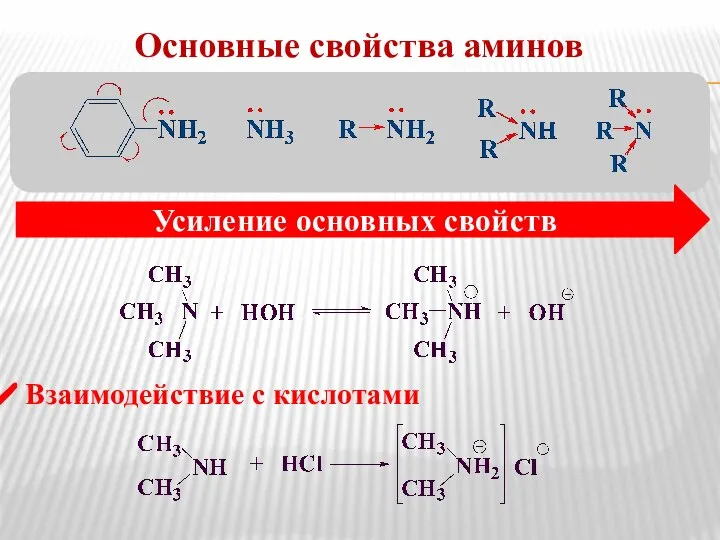
- 13. Основные свойства аминов Взаимодействие с кислотами Усиление основных свойств
- 14. Нуклеофильные свойства аминов Взаимодействие с алкилгалогенидами Взаимодействие с хлорангидридами Взаимодействие с карбонильными соединениями Взаимодействие с эпоксидами
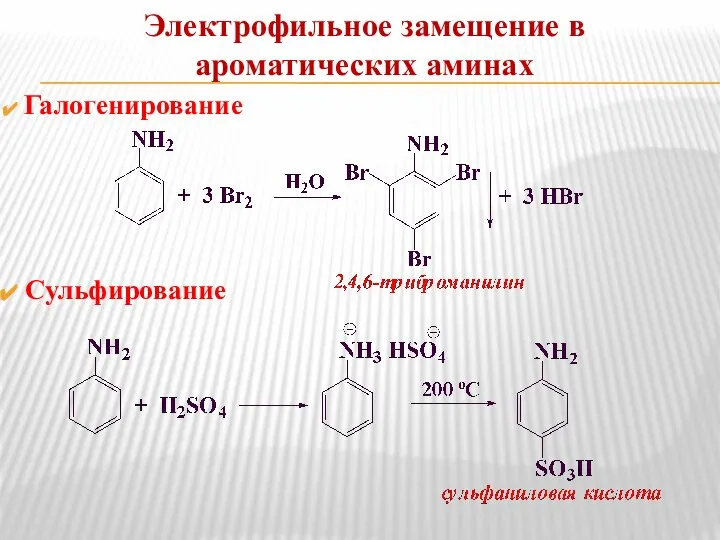
- 15. Электрофильное замещение в ароматических аминах Галогенирование Сульфирование
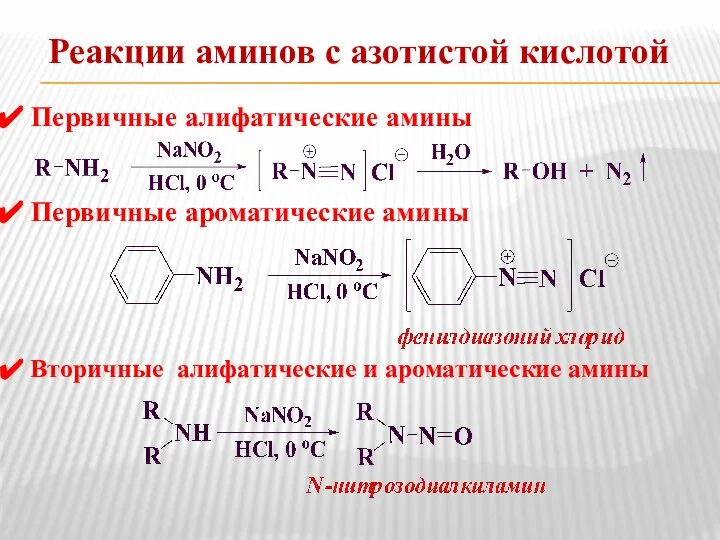
- 16. Реакции аминов с азотистой кислотой Первичные алифатические амины Первичные ароматические амины Вторичные алифатические и ароматические амины
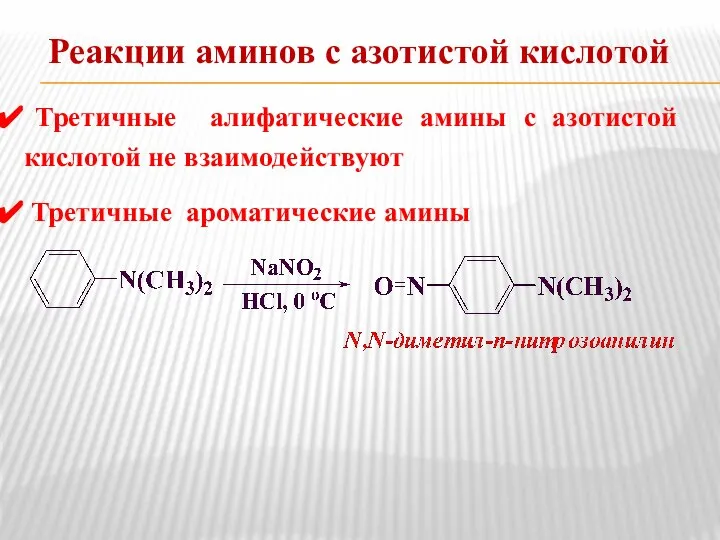
- 17. Реакции аминов с азотистой кислотой Третичные алифатические амины с азотистой кислотой не взаимодействуют Третичные ароматические амины
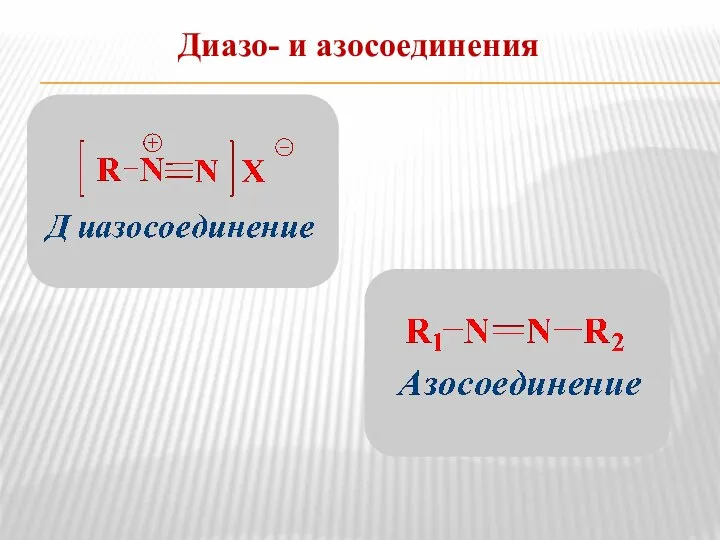
- 18. Диазо- и азосоединения
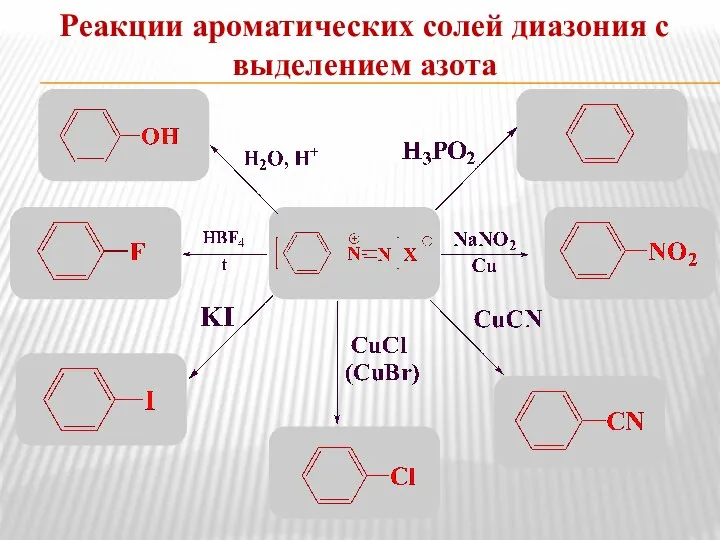
- 19. Реакции ароматических солей диазония с выделением азота
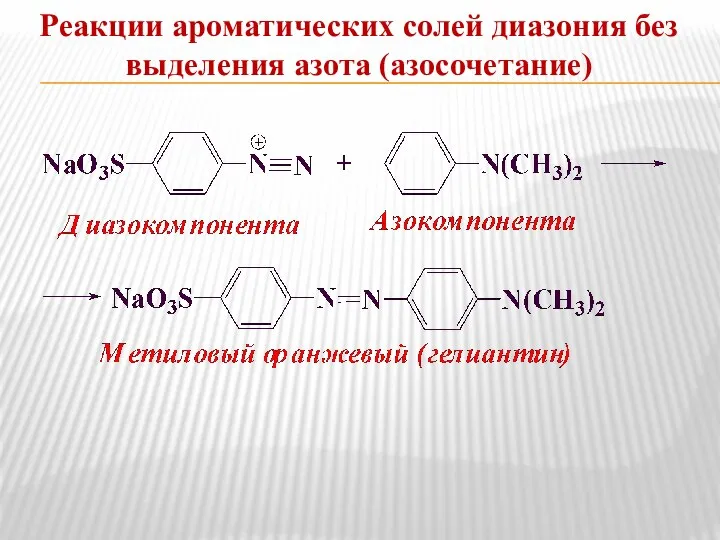
- 20. Реакции ароматических солей диазония без выделения азота (азосочетание)
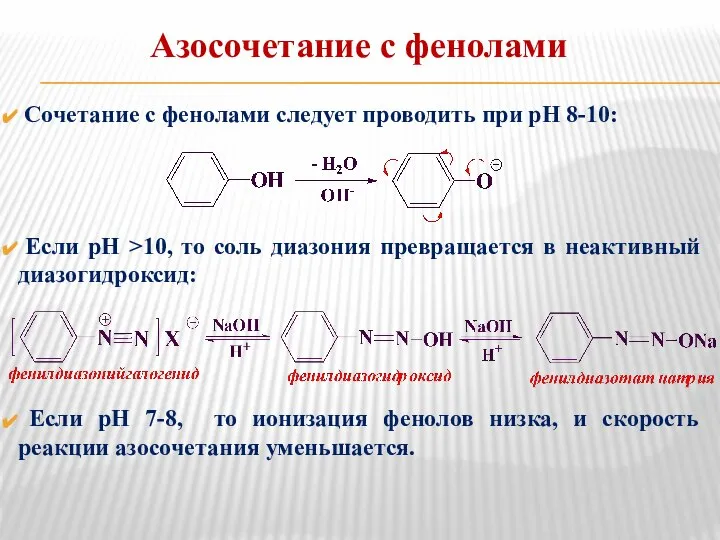
- 21. Сочетание с фенолами следует проводить при рН 8-10: Если рН >10, то соль диазония превращается в
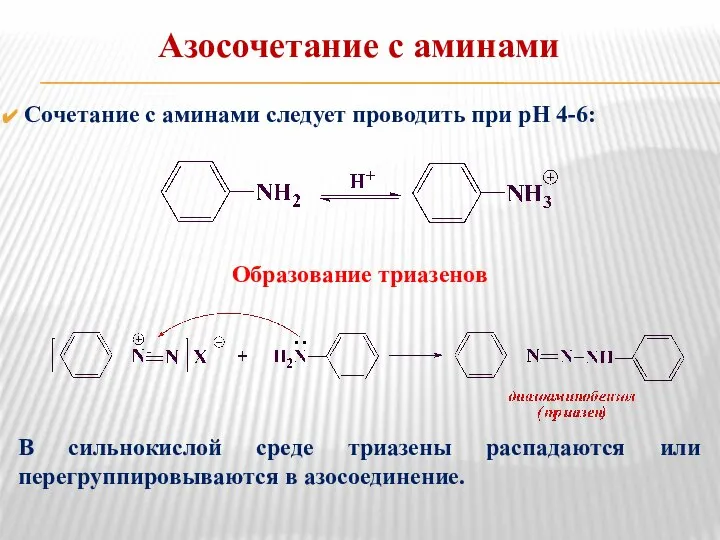
- 22. Азосочетание с аминами Сочетание с аминами следует проводить при рН 4-6: Образование триазенов В сильнокислой среде
- 24. Скачать презентацию





 Соединения железа
Соединения железа Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Кроссворд по теме Металлы
Кроссворд по теме Металлы 01_Osnovnye_ponyatia_i_zakony_khimii
01_Osnovnye_ponyatia_i_zakony_khimii Ковалентная связь
Ковалентная связь Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире ИКТ как средство реализации проблемного обучения на уроках химии
ИКТ как средство реализации проблемного обучения на уроках химии Блок-схема функциональных элементов клеточного метаболизма
Блок-схема функциональных элементов клеточного метаболизма Свойства Н2
Свойства Н2 Органическая химия. Введение
Органическая химия. Введение Кислоты. Химический диктант. 8 класс
Кислоты. Химический диктант. 8 класс Полимерные материалы
Полимерные материалы Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12
Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12 Применение муравьиного спирта
Применение муравьиного спирта Классификация неорганический веществ
Классификация неорганический веществ Презентация на тему Валентность и степень окисления (8 класс)
Презентация на тему Валентность и степень окисления (8 класс)  Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Hydroxidy. Vlastnosti
Hydroxidy. Vlastnosti Круговорот азота в природе
Круговорот азота в природе Кислоты и соли
Кислоты и соли Физические свойства минералов
Физические свойства минералов Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Ұнтақтар - дәрілік түр ретінде
Ұнтақтар - дәрілік түр ретінде Спирты. Классификация, изомерия
Спирты. Классификация, изомерия Виды автомобильного топлива
Виды автомобильного топлива Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Щелочноземельные металлы
Щелочноземельные металлы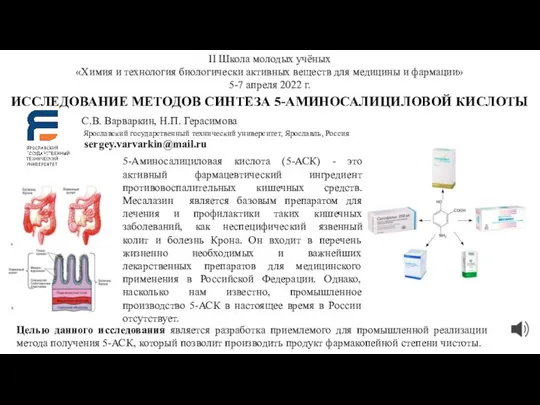 Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты