Слайд 2ФИЗИЧЕСКИЕ СВОЙСТВА
представляет собой бесцветный газ,
который легче воздуха.
Аммиак обладает резко выраженным

запахом нашатырного спирта.
Этот газ очень ядовит и вреден для человека.
Аммиак может находиться в сжиженном, жидком и твердом состоянии.
Жидкий аммиак требует очень тщательного хранения в специальных емкостях, так как является сильнейшим растворителем веществ.
В твердом состоянии аммиак выглядит как бесцветные кристаллы в виде кубиков.
Слайд 3Применение
Аммиак широко применяется в различных охлаждающих установках.
Так же аммиак является отличным

элементом при производстве удобрений, азотной кислоты и соды, взрывчатых веществ,
продуктов химической промышленности. 10-процентный раствор аммиака называется нашатырным спиртом и используется в медицинских целях.
Слайд 4Химические свойства
В химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия

со многими веществами. Степень окисления азота в аммиаке «-3» — минимальная, поэтому аммиак проявляет только восстановительные свойства.
При нагревании аммиака с галогенами, оксидами тяжелых металлов и кислородом образуется азот:
2NH3 + 3Br2 = N2 + 6HBr
2NH3 + 3CuO = 3Cu + N2 + 3H2O
4NH3 +3O2 = 2N2 + 6H2O
Слайд 5В присутствии катализатора аммиак способен окисляться до оксида азота (II):
4NH3 + 5O2 = 4NO

+ 6H2O (катализатор – платина)
аммиак не проявляет кислотные свойства
аствор аммиака в воде имеет щелочную среду:
NH3 + H2O ↔ NH4OH ↔ NH4+ + OH—
При взаимодействии аммиака с кислотами образуются соли аммония, которые при нагревании разлагаются:
NH3 + HCl = NH4Cl
NH4Cl = NH3 + HCl (при нагревании)
Слайд 6Получение аммиака
Выделяют промышленные и лабораторные способы получения аммиака. В лаборатории аммиак получают
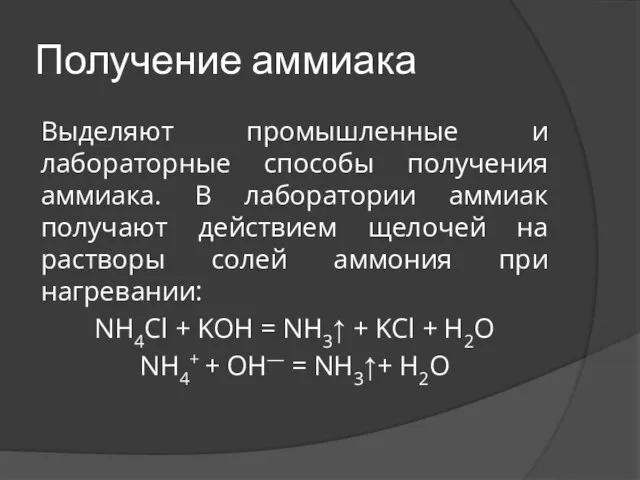
действием щелочей на растворы солей аммония при нагревании:
NH4Cl + KOH = NH3↑ + KCl + H2O
NH4+ + OH— = NH3↑+ H2O
Слайд 7Биологическая роль
Аммиак является важным источником азота для живых организмов. Несмотря на высокое

содержание свободного азота в атмосфере (более 75 %), очень мало живых существ способны использовать свободный газ N2
Некоторые растения зависят от доступности аммиака и других нитрогенных остатков, выделяющихся в почву разлагающимися органическими остатками других растений и животных
Аммиак важен для поддержания нормального кислотно-щелочного баланса крови.
У рыб и водных беспозвоночных аммиак выделяется непосредственно в воду.
Слайд 8Интересные факты
Пары нашатырного спирта способны изменять окраску цветов. Например, голубые и синие
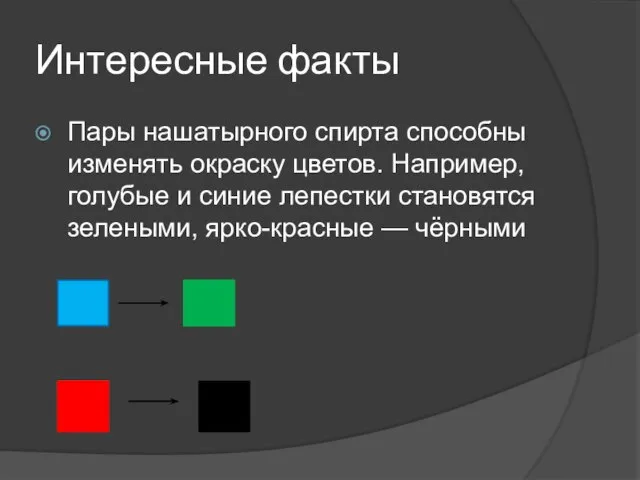
лепестки становятся зелеными, ярко-красные — чёрными
Слайд 9Облака Юпитера состоят из аммиака.
Некоторые цветы, не имеющие запаха от природы, после

обработки аммиаком начинают благоухать. Например, приятный аромат приобретают астры
Слайд 10Нашатырный спирт реагирует с йодом с образованием крайне нестабильного аддукта (иодистый азот)

в сухом кристаллическом состоянии, что используется как эффектный химический опыт.
Слайд 11Аммиак был впервые выделен в чистом виде Дж. Пристли в 1774 году,

который назвал его «щелочной воздух»










 Ароматические углеводороды
Ароматические углеводороды Простое вещество и химический элемент азот
Простое вещество и химический элемент азот Циклические эфиры (окиси)
Циклические эфиры (окиси) Смеси веществ
Смеси веществ Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов
Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов Диффузия в металлах и сплавах
Диффузия в металлах и сплавах Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Электролитическая диссоциация
Электролитическая диссоциация Аналитическая химия (ЛЕКЦИЯ 1)
Аналитическая химия (ЛЕКЦИЯ 1) Получение и химические свойства металлов
Получение и химические свойства металлов Презентация на тему Альдегиды, свойства, получение, применение
Презентация на тему Альдегиды, свойства, получение, применение  Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире Составление химических уравнений
Составление химических уравнений Биологическое значение брома и йода
Биологическое значение брома и йода Многообразие веществ
Многообразие веществ Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Олигосахариды и полисахариды
Олигосахариды и полисахариды Основания. Классификация. Химические и физические свойства
Основания. Классификация. Химические и физические свойства Железо и его соединения
Железо и его соединения агрегатные состояния вещества 7 класс
агрегатные состояния вещества 7 класс Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні Научно-исследовательская деятельность учащихся в процессе изучения химии
Научно-исследовательская деятельность учащихся в процессе изучения химии Приобретённые: недостаточность митохондрий,
Приобретённые: недостаточность митохондрий, Стекло. Виды стекла
Стекло. Виды стекла ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра Органическая химия. Теория строения органических веществ
Органическая химия. Теория строения органических веществ Общая характеристика металлов
Общая характеристика металлов