Слайд 2H2SO4
H2CO3
H2S
HCl
H2SiO3
HNO3
H3PO4

Слайд 3 это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
КИСЛОТЫ

Слайд 4Реакции нейтрализации
HCl + NaOH = NaCl + H2O
H+ + Cl- + Na+
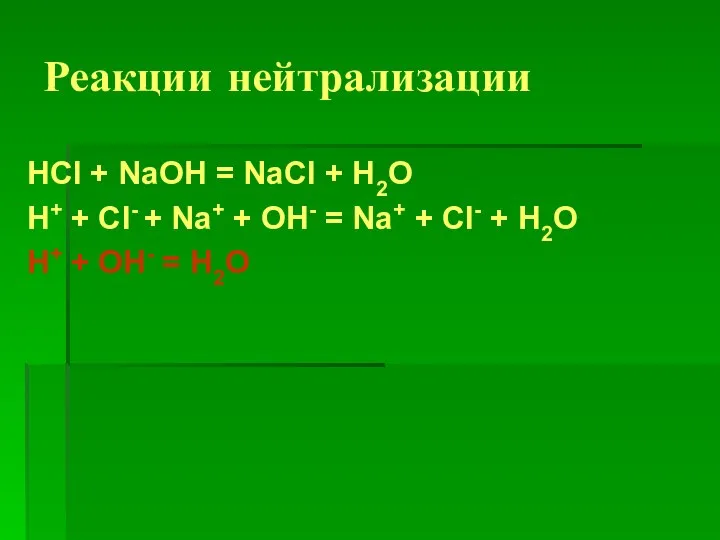
+ OH- = Na+ + Cl- + H2O
H+ + OH- = H2O
Слайд 5Взаимодействие оксида меди (II) с серной кислотой
CuO + H2SO4= CuSO4 +H2O
Внимание! Цифры

в формулах стоят ошибочно. Поставьте их правильно
Слайд 6ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ
CuO + H2SO4 = CuSO4 + H2O
CuO + 2H+

+ SO42- = Cu2+ + SO42- + H2O
CuO + 2H+ = Cu2+ + H2O
Слайд 7ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ
BaCl2 + H2SO4 = BaSO4 + 2HCl
Ba2+ +2Cl- +2H+ +SO42-

= BaSO4 +2H+ +2Cl-
Ba2+ + SO42- = BaSO4
CaCO3 + 2HCl = CaCl2 + H2O + CO2
CaCO3 +2H+ +2Cl- = Ca2+ +2Cl- +H2O +CO2
CaCO3 + 2H+ = Ca2+ + H2O + CO2
Слайд 8Взаимодействие с металлами
Zn + 2HCl = ZnCl2 + H2
Fe +2HCl = FeCl2

+ H2
Слайд 9Правила взаимодействия металлов с кислотами:
Металлы, стоящие до водорода в электрохимическом ряду напряжений

металлов, вытесняют его из растворов кислот.
Соль, образующаяся в реакции должна быть растворима.
Кислота, участвующая в реакции должна быть растворима.
Концентрированный раствор серной кислоты и раствор азотной кислоты любой концентрации взаимодействуют с металлами иначе.
Слайд 10Pb + H2SO4 =
Ag + HCl =
Al + HCl =
2Al + 6HCl

= 2АlCl3 + 3H2









 Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Презентация на тему Уголь
Презентация на тему Уголь  Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Презентация на тему Биография Д. И. Менделеева
Презентация на тему Биография Д. И. Менделеева  Изомерия
Изомерия Разбор задач
Разбор задач Составление ионных уравнений
Составление ионных уравнений Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Основы кристаллографии
Основы кристаллографии Решение задач на смеси, растворы и сплавы
Решение задач на смеси, растворы и сплавы Альдегиды и кетоны
Альдегиды и кетоны План для домашней работы по теме Алкадиены
План для домашней работы по теме Алкадиены Строение и свойства металлов
Строение и свойства металлов Презентация на тему Химические свойства бензола. Получение, применение
Презентация на тему Химические свойства бензола. Получение, применение  Кремний и его соединения
Кремний и его соединения Вода. Растворы
Вода. Растворы Органическая химия
Органическая химия Презентация на тему Оксиды
Презентация на тему Оксиды  Периодическая система и периодический закон. Тест
Периодическая система и периодический закон. Тест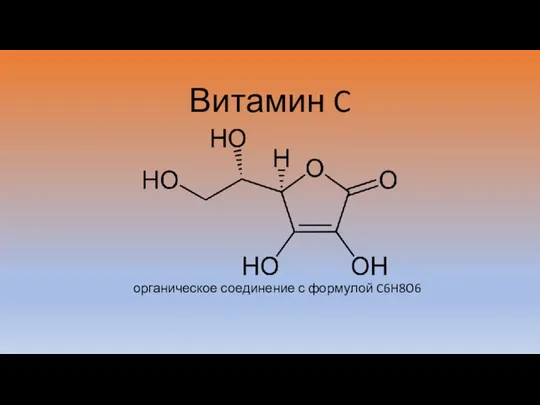 Витамин C
Витамин C Алюминий
Алюминий Очистка поваренной соли
Очистка поваренной соли Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини каталитический крекинг
каталитический крекинг Алканы
Алканы Алюміній. Фізичні та хімічні властивості
Алюміній. Фізичні та хімічні властивості Кислоты. Общая формула кислот
Кислоты. Общая формула кислот