Содержание
- 2. Кислоты — это сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
- 3. Кислоты (по виду кислотного остатка) м кислотный остаток не содержит кислорода бескислородные м кислородосодержащие кислотный остаток
- 4. Кислоты (по виду кислотного остатка) м кислотный остаток не содержит кислорода бескислородные м кислородосодержащие кислотный остаток
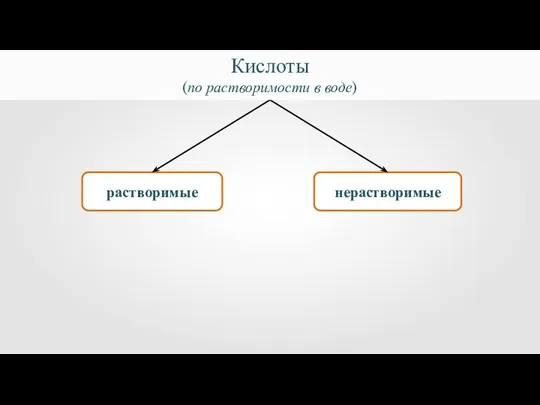
- 5. растворимые нерастворимые Кислоты (по растворимости в воде)
- 6. Растворимые кислоты: H2SO4 — серная кислота, H2S — сероводородная кислота, HNO3 — азотная кислота. Кислоты (по
- 7. Кислоты (по агрегатному состоянию) твёрдые кремниевая кислота (H2SiO3) Майя Пчёлка жидкие серная кислота (H2SO4) хлороводородная кислота
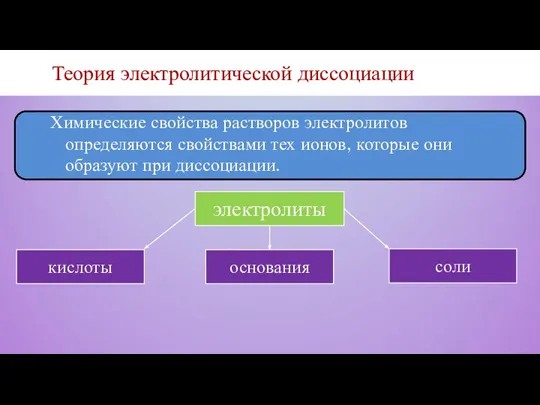
- 9. Теория электролитической диссоциации Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
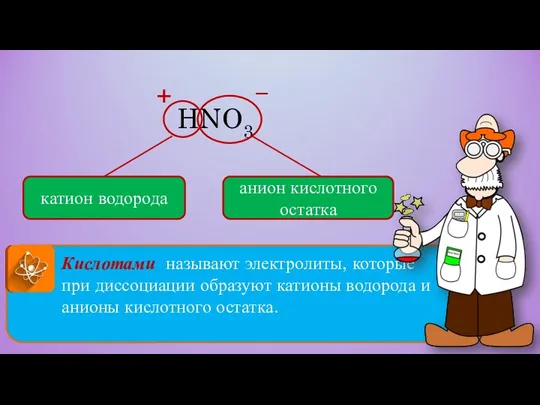
- 10. Кислотами называют электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HNO3 катион водорода
- 14. Скачать презентацию







 Эфирные масла
Эфирные масла Химические и физические свойства воды
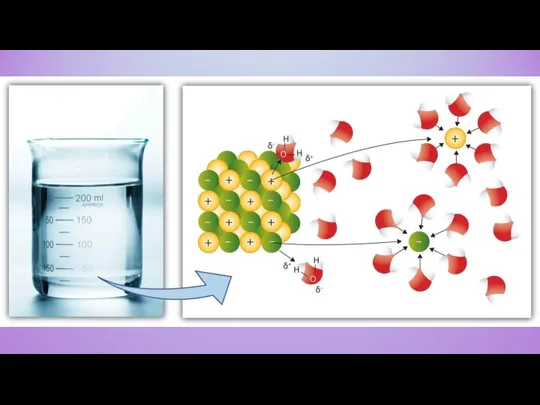
Химические и физические свойства воды Вода
Вода Ковалентная неполярная связь
Ковалентная неполярная связь Салқындатқыш агенттер
Салқындатқыш агенттер Смазывающие вещества
Смазывающие вещества Комплексонометрическое титрование. 5 лекция. Часть 2
Комплексонометрическое титрование. 5 лекция. Часть 2 Ковалентная полярная связь
Ковалентная полярная связь Веселый химический КВН
Веселый химический КВН Презентация на тему Степень окисления (8 класс)
Презентация на тему Степень окисления (8 класс)  Химическое равновесие
Химическое равновесие Строение атома
Строение атома Материаловедение. Модуль
Материаловедение. Модуль История развития химии
История развития химии Занимательная химия Программу составил
Занимательная химия Программу составил  Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода Патриотическое воспитание школьников на уроках
Патриотическое воспитание школьников на уроках Азотные удобрения
Азотные удобрения Обобщение. Неметаллы
Обобщение. Неметаллы Пространственная изомерия органических соединений
Пространственная изомерия органических соединений Ода стеклу и городу-герою Керчи
Ода стеклу и городу-герою Керчи Молекулярно-массовое распределение
Молекулярно-массовое распределение Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства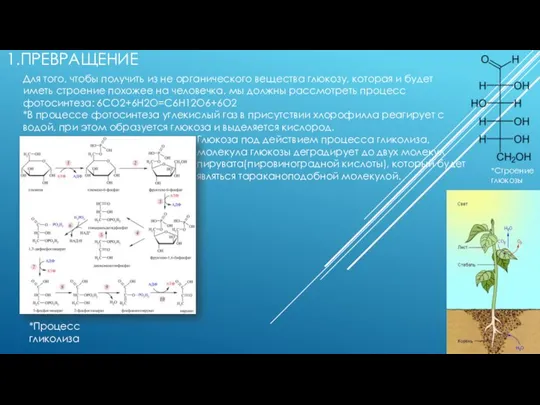 Превращение из не органического вещества в глюкозу
Превращение из не органического вещества в глюкозу Особенности строения электронных оболочек атомов элементов больших периодов
Особенности строения электронных оболочек атомов элементов больших периодов Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Производство метанола
Производство метанола Проточные реакторы непрерывного действия. (Лекция 5)
Проточные реакторы непрерывного действия. (Лекция 5)