Содержание
- 2. Эпиграф: Опыт! Скажи, чем гордишься ты? Что ты такое? Ты плод ошибок и слёз, Силам потраченным
- 3. Проблемный вопрос: Изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
- 4. ВСПОМНИ ! Признаки химических реакций Изменение цвета, вкуса, запаха Образование осадка или его растворение Выделение газа
- 5. FeСl3 + 3KCNS = Fe(CNS)3 + 3KСl ВСПОМНИ ! Химическим уравнением называется условная запись химической реакции
- 6. Тема урока: Закон сохранения массы веществ
- 7. - уметь объяснить данный закон с позиции атомно-молекулярного учения - научиться применять его при составлении уравнений
- 8. Сущность химической реакции ВСПОМНИ ! В результате химической реакции количество атомов не меняется, поэтому масса веществ
- 9. 2NaOH + CuSO4= Na2SO4 + Cu (OH)2 Уравнение химической реакции
- 10. Na2 СO3 + H2SO4= Na2SO4 + H2O + СО2 Уравнение химической реакции
- 11. ЛОМОНОСОВ Михаил Васильевич 8 (19) ноября 1711 г. деревня Мишанинская Куростровской волости Архангелогородской губ. — –
- 13. БОЙЛЬ Роберт (1627-1691), английский химик и физик, один из учредителей Лондонского королевского общества. Родоначальник современной химии
- 15. В 1789 г. этот же закон был независимо от М.В. Ломоносова установлен французским химиком А.Л. Лавуазье,
- 16. «Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько
- 17. Na2 СO3 + H2SO4= Na2SO4 + H2O + СО2 На основании закона сохранения массы веществ составляются
- 18. Na2 СO3 + H2SO4= Na2SO4 + H2O + СО2 На основании закона сохранения массы веществ составляются
- 19. Na2 СO3 + H2SO4= Na2SO4 + H2O + СО2 На основании закона сохранения массы веществ составляются
- 20. Na2 СO3 + H2SO4= Na2SO4 + H2O + СО2 На основании закона сохранения массы веществ составляются
- 21. Na2 СO3 + H2SO4= Na2SO4 + H2O + СО2 На основании закона сохранения массы веществ составляются
- 22. Na2 СO3 + H2SO4= Na2SO4 + H2O + СО2 На основании закона сохранения массы веществ составляются
- 23. Na2 СO3 + H2SO4= Na2SO4 + H2O + СО2 На основании закона сохранения массы веществ составляются
- 24. Коэффициенты в уравнении реакции показывают: число молекул веществ количество вещества
- 25. Общий вывод: Все химические процессы, происходящие в природе, подчиняются закону сохранения массы веществ, поэтому он является
- 26. Домашнее задание: пп. 18, с. 62 - 65, упр.№2. Желаю удачи! Время пошло… .
- 27. Тест 1.Атом – это… а) мельчайшая частица вещества, сохраняющая его химические свойства б) мельчайшая химически неделимая
- 28. Ответы 1.Атом – это… а) мельчайшая частица вещества, сохраняющая его химические свойства б) мельчайшая химически неделимая
- 30. Скачать презентацию



























 Основные положения теории строения органических соединений А.М. Бутлерова
Основные положения теории строения органических соединений А.М. Бутлерова презентация арены 1
презентация арены 1 Prezentatsia_Microsoft_PowerPoint (1)
Prezentatsia_Microsoft_PowerPoint (1)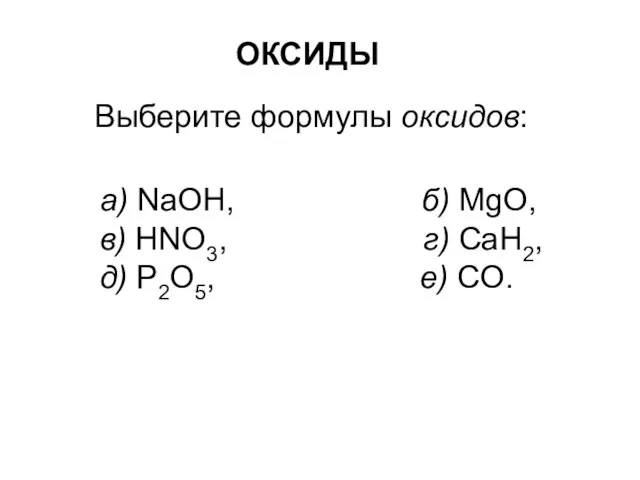 Оксиды
Оксиды Алкены. Химические и физические свойства
Алкены. Химические и физические свойства Контрольна робота, хімія
Контрольна робота, хімія alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1
alkany_stroenie_nomenklatura_izomeriya_10_klass (3)-1 Природный газ
Природный газ Строение атома. Химия, 8 класс
Строение атома. Химия, 8 класс Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Типы химической связи и кристаллических решеток
Типы химической связи и кристаллических решеток Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Опыты с хондроитин сульфатом
Опыты с хондроитин сульфатом ZhK_Prezentatsia_1
ZhK_Prezentatsia_1 Водород
Водород Химия в быту
Химия в быту Золото
Золото 9_OSNOVY_KOLANALIZA
9_OSNOVY_KOLANALIZA Применение солей
Применение солей Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП
Синтез оксида меди и йодида меди для формирования буферных слоев для ГОНП Презентация на тему Органическая химия. Жиры
Презентация на тему Органическая химия. Жиры  Электролиз
Электролиз Кинетика физико-химических процессов
Кинетика физико-химических процессов Виды химической связи
Виды химической связи Школа юных ученых. Соль
Школа юных ученых. Соль Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Простые вещества – неметаллы. Получение и химические свойства неметаллов
Простые вещества – неметаллы. Получение и химические свойства неметаллов Занимательная химия Программу составил
Занимательная химия Программу составил