Слайд 2Поверхностные явления – процессы, протекающие на границе раздела фаз и обусловленные особенностями

состава и структуры поверхностей.
Слайд 3Поверхностное натяжение
[Дж/м2]
Физический смысл σ:
Энергия (Дж/м2)
Сила (Н/м)
σН2О = 72,75⋅10-3 Дж/м2 при 298о
![Поверхностное натяжение [Дж/м2] Физический смысл σ: Энергия (Дж/м2) Сила (Н/м) σН2О =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1179327/slide-2.jpg)
К
Слайд 4Зависимость σ от С называется изотерма поверхностного натяжения.
1- ПАВ Δσ/ΔС < 0 ЕН2О-Н2О
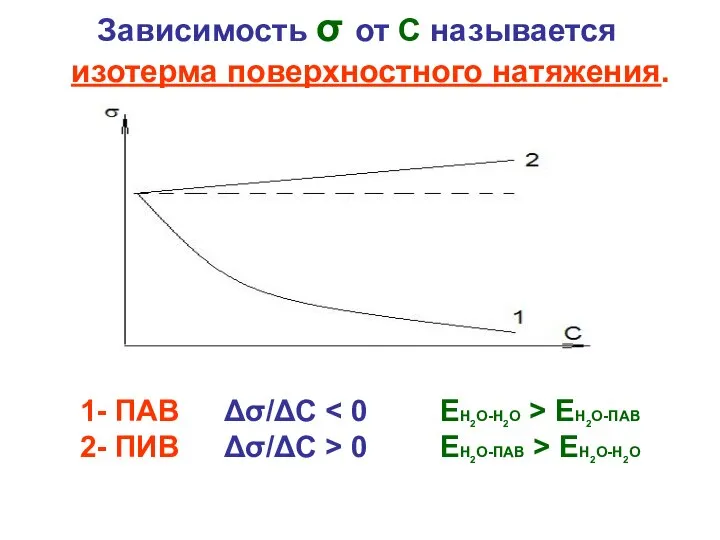
> ЕН2О-ПАВ
2- ПИВ Δσ/ΔС > 0 ЕН2О-ПАВ > ЕН2О-Н2О
Слайд 5Поверхностная активность – способность растворенных веществ изменять поверхностное натяжение.
Мера поверхностной активности
-

(dσ/dC) или - (Δσ/ΔC)
Слайд 6Уравнение Шишковского
σ = σо – В ln(1+AC),
С – концентрация ПАВ
Определение σ: 1) статические
2)

полустатические
3)динамические
Слайд 7Правило Дюкло-Траубе:
β = Gn+1 / Gn = 3 ÷ 3,5
(для спиртов и

карбоновых кислот)
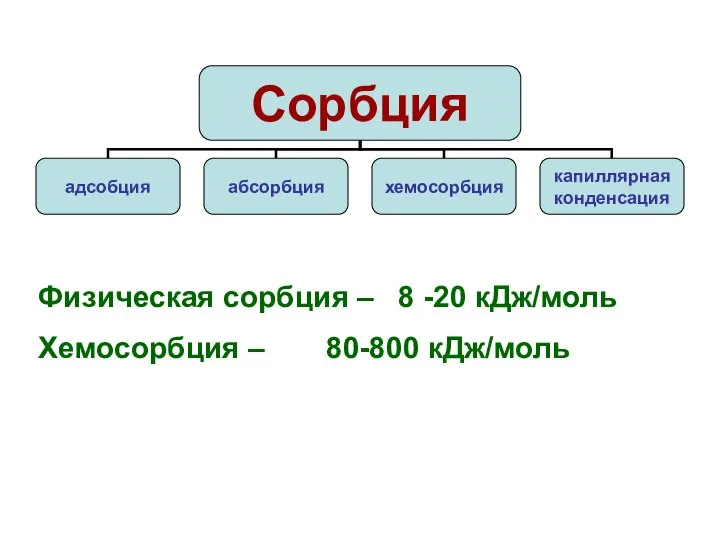
Слайд 8Физическая сорбция – 8 -20 кДж/моль
Хемосорбция – 80-800 кДж/моль
Слайд 10Теория мономолекулярной адсорбции Лэнгмюра
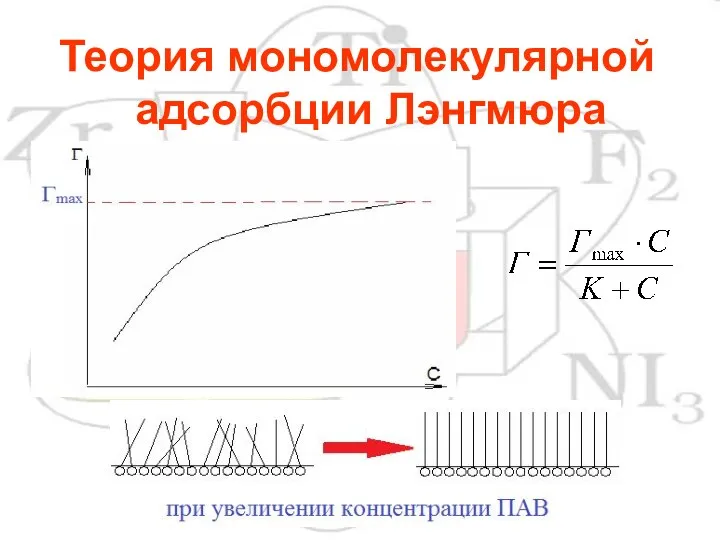
Слайд 12По величине Гmax можно рассчитать So и l молекул ПАВ в мономолекулярном

слое
Слайд 13Адсорбция на твердых сорбентах
Уравнение Фрейндлиха

Слайд 15Правило Шилова:
чем лучше вещество растворяется в данном растворителе, тем хуже оно из
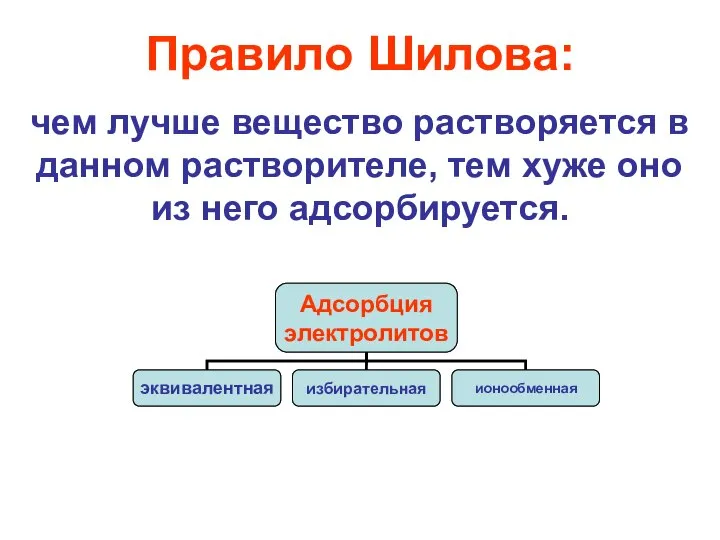
него адсорбируется.
Слайд 16Правило Панета-Фаянса:
из всех ионов в растворе в первую очередь адсорбируются те,

которые входят в состав сорбента, или имеют с ним общие группы.
Слайд 17 Обменная емкость ионита - ммоль ионов на 1 г сухого и

1 мл набухшего ионита
Слайд 18Адсорбция лежит в основе важнейших биологических процессов:
с адсорбции начинается поглощение различных

веществ клетками и тканями организма
взаимодействие ферментов с субстратами для протекания ферментативных реакций
адсорбция является основным физико-химическим механизмом работы иммунной системы (образование комплекса «антиген-антитело»)
Слайд 19Адсорбция лежит в основе важнейших биологических процессов:
4) удаление из крови различных токсических

веществ, вирусов, бактерий (гемосорбция)
5) удаление токсинов из ЖКТ (альмагель, фосфолюголь и др.)
6) ПАВ вводится в лекарственные препараты для улучшения всасывания (конферон)
Слайд 20Типы сорбентов, использующихся для удаления различных веществ

Слайд 21Для очистки крови больных спидом применяют силикатную матрицу с введенными в ее

структуру амино- или карбоксильными группами.
Явление адсорбции лежит в основе хроматографии (М.С. Цвет, 1904 г.)
Слайд 22Хроматография – область науки, изучающая процессы, основанные на перемещении зоны вещества вдоль

слоя сорбента в потоке подвижной фазы и связанные с многократным повторением сорбционных и десорбционных актов
Слайд 23«Хроматография – цветозапись» 1903 г. М.С. Цвет
г. Воронеж. Экскурсия у могилы основателя

хроматографии М.С. Цвета
Слайд 24Эксперимент М.С. Цвета по разделению хлорофилла (адсорбент СаСО3)
1 – бесцветная зона (коллоидное

примеси)
2 – желтая зона (ксантофилл β)
3 – желто-зеленая зона (хлорофиллин β)
4 – Зелено-синяя зона (хлорофиллин α)
5 – желтая зона (ксантофилл)
6 – желтая зона (ксантофилл α)
7 – желтая зона (ксантофилл α)
8 – серо-стальная зона (хлорофиллин)
Слайд 25Подвижная фаза (ПФ) – газ или жидкость.
Неподвижная фаза (стационарная фаза) (НФ) –

твердое тело, жидкость (сорбент).
Слайд 26
Необходимые условия:
1. Наличие ПФ и НФ.
2. Многократные повторения актов сорбции и десорбции.
3.

Равновесие «сорбция ↔десорбция» должно устанавливаться быстро
Слайд 27Выходные кривые разделения сложной газовой смеси на хроматографе (газовая хроматография)
(от метана до
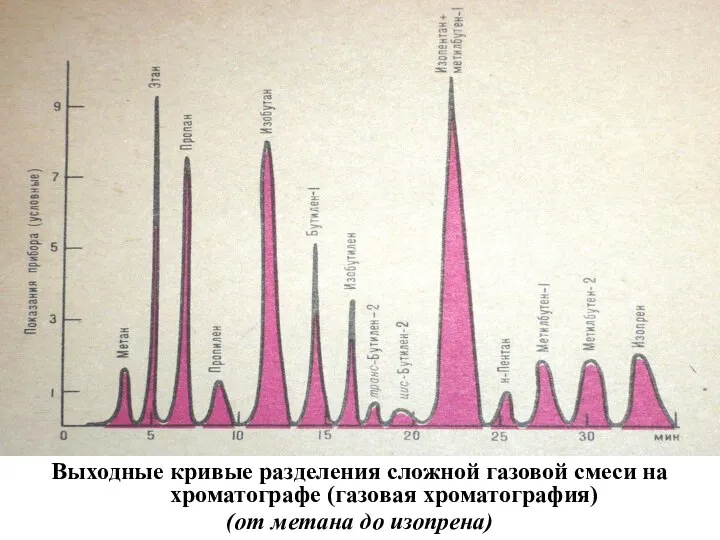
изопрена)
Слайд 28 Хроматограмма образцов героина
а- и б- идентичные образцы, в- другой источник приобретения
1

– кофеин, 2 – фенобарбитон,
3 – метаквалон, 4 – ацетилморфин,
5 – деаморфин, 6 – папаверин,
7 - наркотин
Слайд 29Жидкостный хроматограф фирмы «Кнауэр» (Германия)

Слайд 30Кривая элюирования смеси щелочных металлов
(метод ионообменной хроматографии – элюент 0,25 н
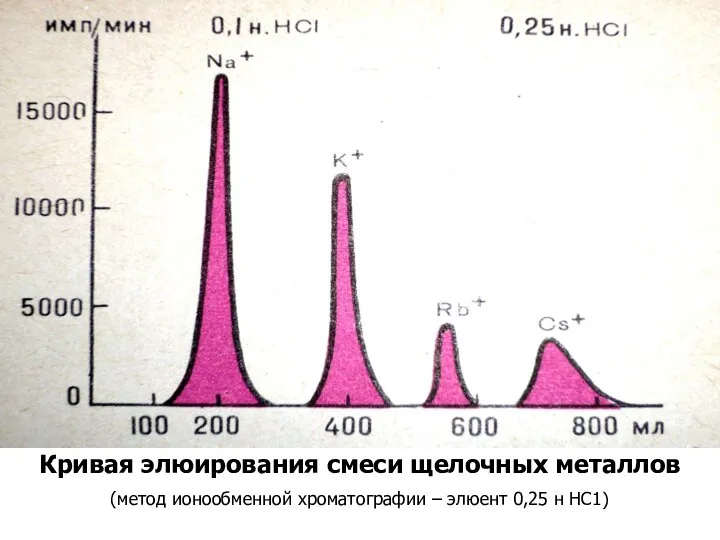
НС1)
Слайд 31Ионный хроматограф «Цвет – 3006» (СССР)

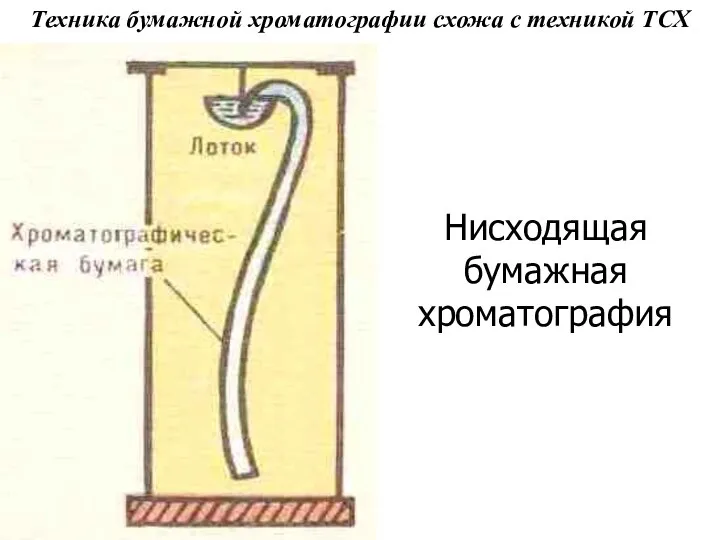
Слайд 32Техника бумажной хроматографии схожа с техникой ТСХ
Нисходящая бумажная хроматография

![Поверхностное натяжение [Дж/м2] Физический смысл σ: Энергия (Дж/м2) Сила (Н/м) σН2О =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1179327/slide-2.jpg)





![Уравнение Гиббса [моль/м2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1179327/slide-8.jpg)



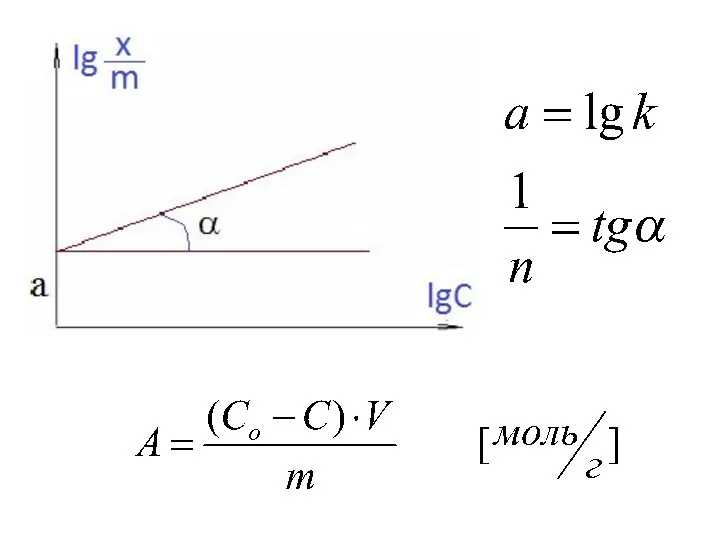


















 Подготовка к контрольной работе по теме «Изменения, происходящие с веществами
Подготовка к контрольной работе по теме «Изменения, происходящие с веществами Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Углеводороды. Изомеры и гомологи
Углеводороды. Изомеры и гомологи Презентация на тему Моющие средства
Презентация на тему Моющие средства  Закономерности изменения свойств элементов и их соединений по периодам и группам
Закономерности изменения свойств элементов и их соединений по периодам и группам Азотная кислота
Азотная кислота Презентация на тему Драгоценные камни
Презентация на тему Драгоценные камни  Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Презентация на тему Теория строения органических соединений А. М. Бутлерова
Презентация на тему Теория строения органических соединений А. М. Бутлерова  Химический состав продуктов питания
Химический состав продуктов питания Свойства Н2
Свойства Н2 Задачи химической кинетики
Задачи химической кинетики Научно-познавательное шоу Юный химик
Научно-познавательное шоу Юный химик Ионная связь. Вещества ионного ( немолекулярного) строения
Ионная связь. Вещества ионного ( немолекулярного) строения Периодический закон Д.И.Менделеева
Периодический закон Д.И.Менделеева Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Алканы
Алканы Способы выражения концентраций растворов
Способы выражения концентраций растворов Круговорот азота
Круговорот азота Органическая химия. Центр дистанционного обучения
Органическая химия. Центр дистанционного обучения Коррозия металла
Коррозия металла Аллиты, ферриты, манганаты
Аллиты, ферриты, манганаты Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) Предмет органической химии
Предмет органической химии Кафедра общей и биоорганической химии
Кафедра общей и биоорганической химии