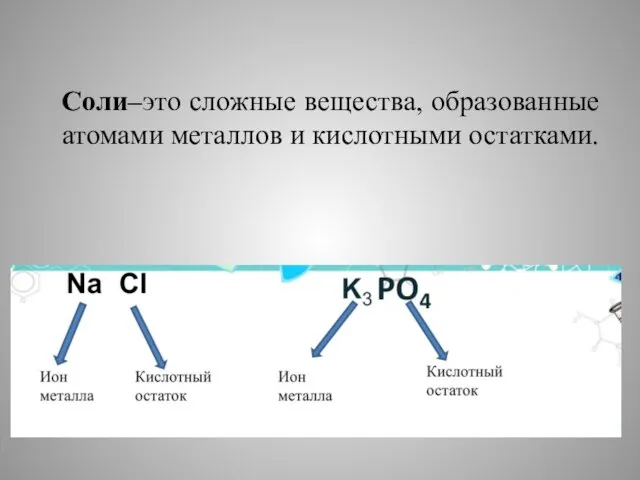
Слайд 2 Соли–это сложные вещества, образованные атомами металлов и кислотными остатками.
Слайд 3Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония

(NH+4) и анионы кислотных остатков.
Например, диссоциация средних солей :
(NH4)2SO4 -> 2NH₄++ SO₄2-;
Na3PO 4 -> 3 Na + + PO₄3-
Слайд 4Номенклатура солей
Название Название Указание
Кислотного + металла (в Р.п.) + валентности
остатка (если она

переменная)
NaCl хлорид натрия
CaCO3 карбонат кальция
Са3(РО4)2 фосфат кальция
МgCI2 хлорид магния
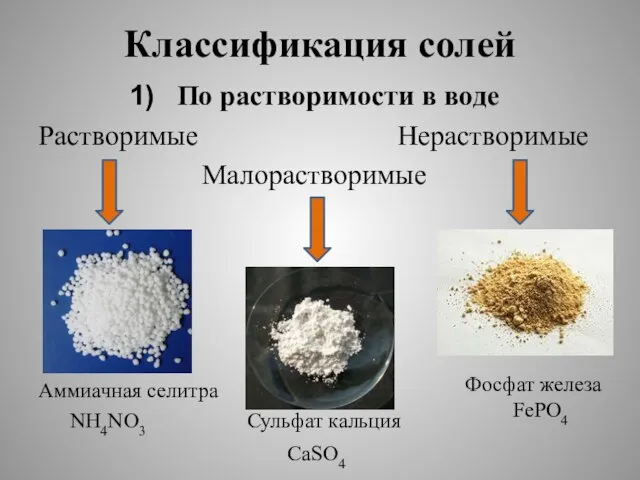
Слайд 5Классификация солей
По растворимости в воде
Растворимые Нерастворимые
Малорастворимые
Аммиачная селитра
NH4NO3 Сульфат кальция
Фосфат железа
Слайд 7Классификация солей
2) По наличию или отсутствию кислорода
Кислородсодержащие Бескислородные
Например: Например:
Na2SO4
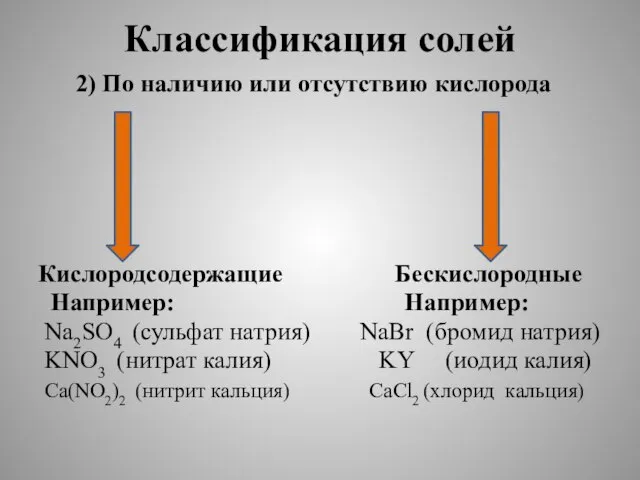
(сульфат натрия) NaBr (бромид натрия)
KNO3 (нитрат калия) KY (иодид калия)
Ca(NO2)2 (нитрит кальция) CaCl2 (хлорид кальция)
Слайд 9Разновидности солей
Соли бывают:
Средние соли – это продукты полного замещения атомов водорода в

кислоте на металл.
Например: Na2CO3 (карбонат натрия)
CuSO4 (сульфат меди)
Слайд 10Разновидности солей
2) Кислые соли – это продукты неполного замещения атомов водорода

в кислоте на металл.
Например:
NaHCO3 (гидрокарбонат натрия)
Mg(HSO4)2 (гидросульфат магния)
Слайд 11Разновидности солей
3) Основные соли – это продукты неполного замещения гидроксогрупп в

основании на кислотный остаток.
Например:
(CuOH)2CO3 (гидроксокарбонат меди (II))
AlOHCl2 (гидроксохлорид алюминия)
Слайд 13Физические свойства:
Все соли твердые кристаллические вещества. Соли имеют различную окраску, и разную

растворимость в воде.
Слайд 14Химические свойства
Соль + кислота = другая соль + другая кислота
Например: H2SO4 +
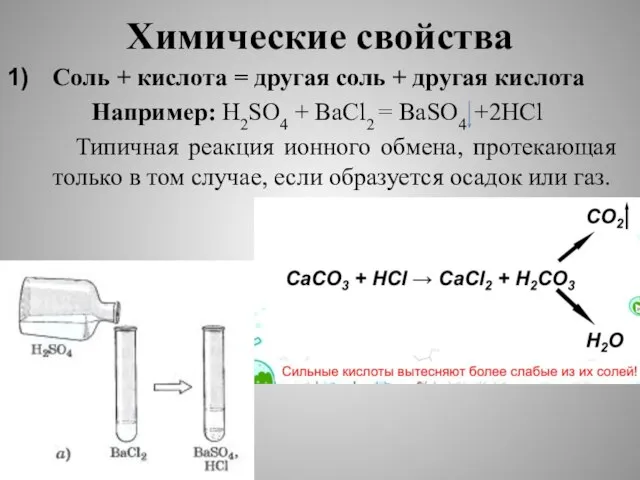
BaCl2 = BaSO4 +2HCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Слайд 15Химические свойства
2) Соль + щелочь = другая соль + другое основание
Например: NaOH
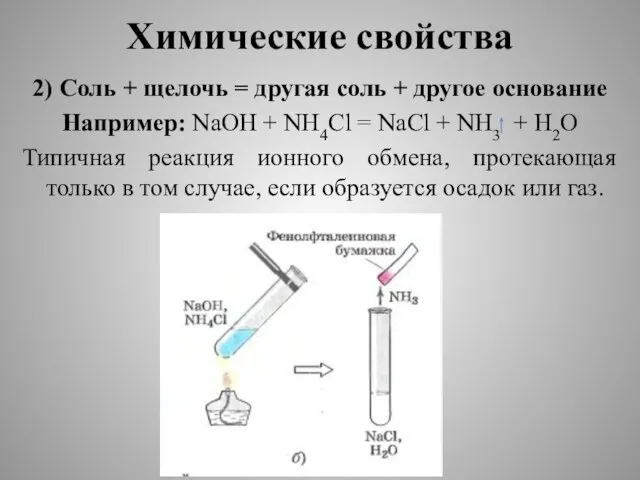
+ NH4Cl = NaCl + NH3 + H2O
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Слайд 16Химические свойства
3) Соль1 + соль2 = соль3 + соль4
Например: Na2SO4

+ BaCl2 = BaSO4 +2NaCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок.
Слайд 17Химические свойства
4) Соль + металл = другая соль + другой металл
Например: CuSO4(p-p)

+ Fe = FeSO4 (p-p) + Cu
Правила: а) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений;
б) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II группы ПС Д.И.Менделеева не вытесняют другие металлы из растворов солей.


















 Презентация на тему Типы изомерии
Презентация на тему Типы изомерии  Шаблон для презентации по химии
Шаблон для презентации по химии 6. Характеристика элементов на основе положения в периодической системе
6. Характеристика элементов на основе положения в периодической системе Решение расчетных задач по химии
Решение расчетных задач по химии Презентация на тему Моющие и чистящие средства
Презентация на тему Моющие и чистящие средства  Блеск и сила волос с точки зрения химии
Блеск и сила волос с точки зрения химии Вещество. Простые и сложные вещества
Вещество. Простые и сложные вещества Свойства воды. Физические свойства
Свойства воды. Физические свойства Биосинтез пиримидиновых нуклеотидов
Биосинтез пиримидиновых нуклеотидов Химия. 8 класс
Химия. 8 класс Комісія хімічних дисциплін
Комісія хімічних дисциплін Vvedenie_v_khimiyu
Vvedenie_v_khimiyu Графит. 9 класс
Графит. 9 класс Каучук, резина
Каучук, резина Общие свойства неметаллов
Общие свойства неметаллов Как решить задания тестов ЕГЭ по химии, если знания на базовом уровне. Метод исключения
Как решить задания тестов ЕГЭ по химии, если знания на базовом уровне. Метод исключения Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Диффузия и осмос
Диффузия и осмос Предмет химии. Вещества и их свойства
Предмет химии. Вещества и их свойства Харктеристика металлов
Харктеристика металлов Алкены
Алкены Учебное задание Расчет теплоты сгорания
Учебное задание Расчет теплоты сгорания Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Алкены. Строение, номенклатура, изомерия
Алкены. Строение, номенклатура, изомерия Природные кислоты и щелочи. Индикаторы
Природные кислоты и щелочи. Индикаторы Металлическая ионная ковалентная связи
Металлическая ионная ковалентная связи Загадочный фосфор
Загадочный фосфор