Содержание
- 2. Атомы химических элементов Содержание: Основные сведения о строении атомов: Доказательства сложности строения атома Состав атома Состав
- 3. Демокрит (460–371 гг. н.э.) Древнегреческий ученый, философ-материалист. Ученик Левкиппа. Родился в Абдере (Фракия). Сочинения Демокрита по
- 4. Ломоносов Михаил Васильевич (1711–1765) Русский ученый, с 1745 г. академик Петербургской АН. Изложил в 1741–1750 гг.
- 5. Дальтон Джон (1766–1844) Английский химик и физик, с 1822 г. член Лондонского королевского общества. Родился в
- 6. Томсон Джон Паджет (1892–1975) Английский физик, в 1930 г. член Лондонского королевского общества. Родился в Кембридже.
- 7. Резерфорд Эрнст (1871–1937) Английский физик, с 1903 г. член Лондонского королевского общества, его президент в 1925–1930
- 8. Наименьшая электронейтральная частица химического элемента, являющаяся носителем его свойств. Атом
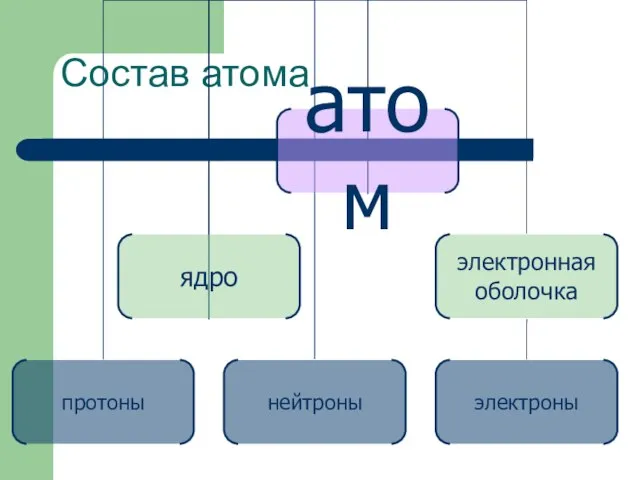
- 9. Состав атома
- 10. Размер атомов Атом имеет очень малые размеры, порядка долей нанометра 1 нм = 10-9м Размеры атомов
- 11. Состав атома Все известные химические элементы приведены в таблице Д. И. Менделеева. В ней они располагаются
- 12. Атомное ядро Практически вся масса атома (более 99,95%) сосредоточена в очень малом объеме – в ядре
- 13. Ядро
- 14. Электроны Все вещества электронейтральны. Атомы – составные части вещества, следовательно, атомы в целом должны быть нейтральны.
- 15. Движение электрона в атоме Электроны в атоме не могут быть неподвижными. Если бы электрон был неподвижным,
- 16. Все известные химические элементы приведены в таблице Д. И. Менделеева. В ней они располагаются в порядке
- 17. Задание №1 Определите состав атома элемента номер: 1вариант 2 вариант 6 1)17 18 (Ar, Ar, Ar)
- 18. Алгоритм 1.Выберите элемент в ПСХЭ и запишите его знак 2.Запишите атомный номер элемента Z и его
- 19. Задание №2 1.Откройте ОК «Химия, 8 кл.»; 2.компонент «Курсы»; 3.закладка «Учебники»; 4.Габриелян О.С., глава 1, основные
- 21. Скачать презентацию

















 Строение и функции нуклеиновых кислот. Лекция №3
Строение и функции нуклеиновых кислот. Лекция №3 Ода стеклу и городу-герою Керчи
Ода стеклу и городу-герою Керчи Химическая связь в твердых телах. Экзаменационные вопросы
Химическая связь в твердых телах. Экзаменационные вопросы Презентация на тему Кислород (9 класс)
Презентация на тему Кислород (9 класс)  Гигиена воздуха
Гигиена воздуха Жиры
Жиры Современные инновации в области химической промышленности и пути её развития
Современные инновации в области химической промышленности и пути её развития Типичные реакции кислот
Типичные реакции кислот Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай
Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай Эмульсии
Эмульсии 28f89e0351fe4e509cc73515a12a26d5
28f89e0351fe4e509cc73515a12a26d5 Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год
Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год Липиды. Омыляемые липиды. Рубежный контроль №2
Липиды. Омыляемые липиды. Рубежный контроль №2 Опыт разработки учебно-методического комплекса Химия
Опыт разработки учебно-методического комплекса Химия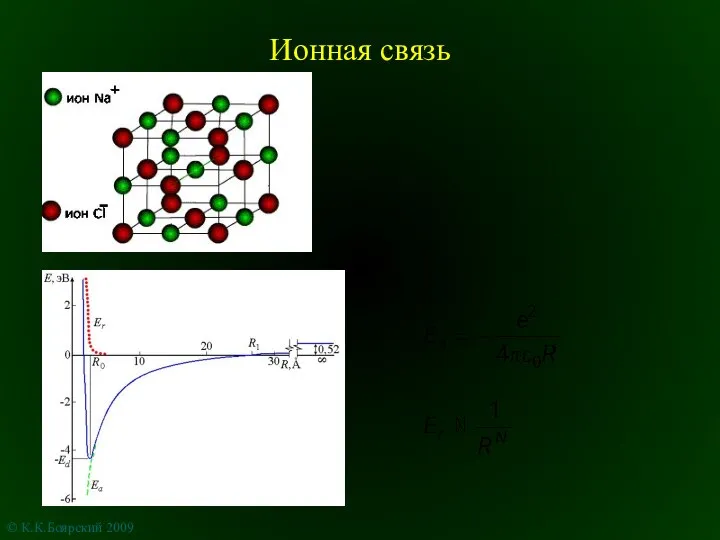 Ионная связь
Ионная связь Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Презентация на тему Полимеры
Презентация на тему Полимеры  Комплексные соединения
Комплексные соединения Мицелла. Строение мицеллы
Мицелла. Строение мицеллы Периодическая система Д. И. Менделеева. Знаки химических элементов
Периодическая система Д. И. Менделеева. Знаки химических элементов Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов агрегатные состояния вещества 7 класс
агрегатные состояния вещества 7 класс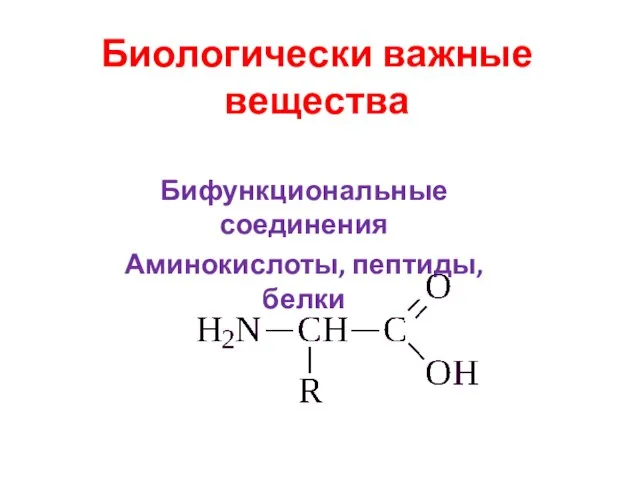 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Сфера влияния химии
Сфера влияния химии Химические свойства кислот
Химические свойства кислот Алкены. Физические и химические свойства
Алкены. Физические и химические свойства Алкены.Номенклатура
Алкены.Номенклатура Буферные системы
Буферные системы