Содержание
- 2. H2SO4 производство удобрений, химических волокон, пластмасс, лекарств. Ею заполняют кислотные аккумуляторы, используют для извлечения металлов из
- 3. HNO3 – производство удобрений, лаков, красителей, пластмасс, взрывчатых и лекарственных веществ. H3PO4 входит в состав обезжиривающих
- 4. C9H8O4 (ацетилсалициловая кислота) эффективна при профилактике заболеваний сердечно-сосудистой системы, уменьшает образование тромбов, обладает анальгезирующим эффектом, поэтому
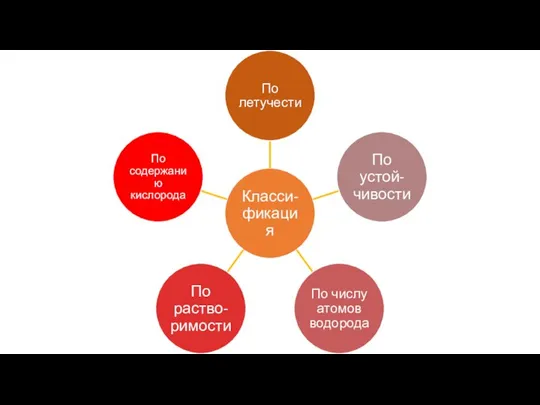
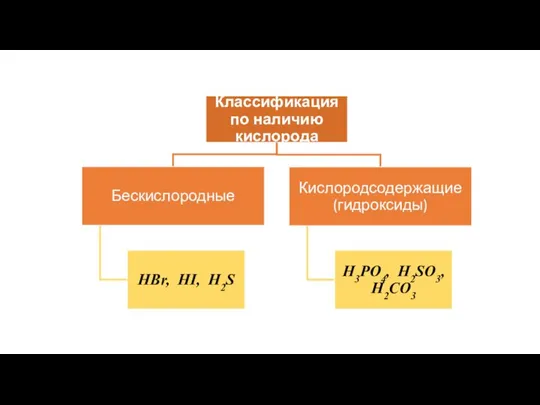
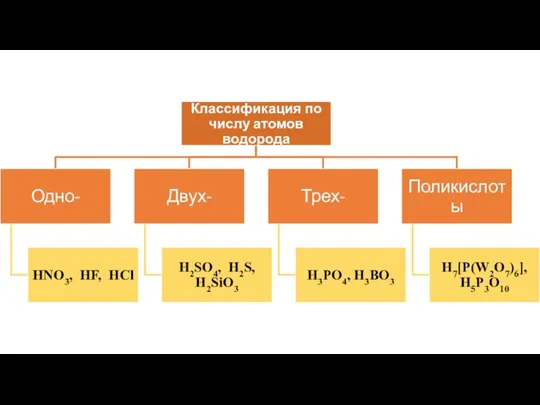
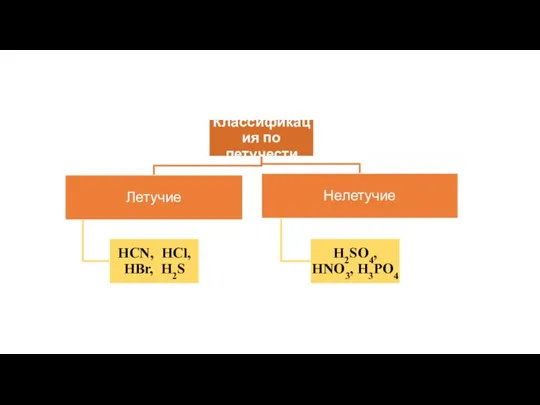
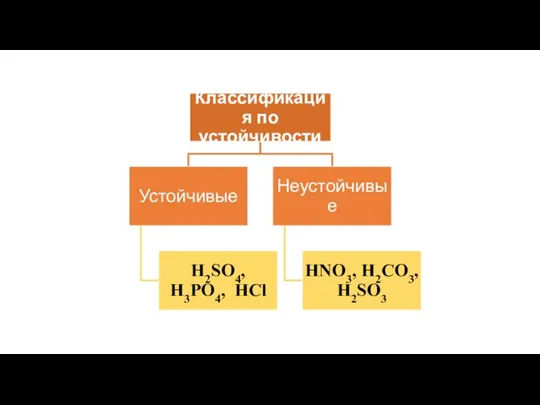
- 5. Кислоты – как класс неорганических соединений
- 6. Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода, способных замещаться на атомы металла,
- 12. Физические свойства кислот
- 13. Кислоты - чаще всего, жидкости хорошо растворимые в воде, например серная кислота, азотная кислота, фосфорная кислота,
- 14. Химические свойства кислот
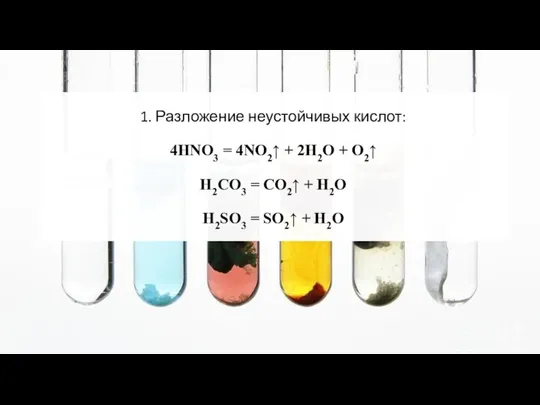
- 15. 1. Разложение неустойчивых кислот: 4HNO3 = 4NO2↑ + 2H2O + O2↑ H2CO3 = CO2↑ + H2O
- 16. 2. Взаимодействие растворов кислот с активными и малоактивными металлами Активные металлы стоят в электрохимическом ряду напряжения
- 17. Взаимодействие растворов кислот с активными металлами Me + раствор кислоты = соль + H2 По данной
- 18. 3. Взаимодействие с оксидами металлов раствор кислоты + основный оксид = соль металла + вода 2HNO3
- 19. 4. Взаимодействие с растворимыми основаниями (щелочами) Реакция нейтрализации раствор кислоты + основание (щёлочь) = соль металла
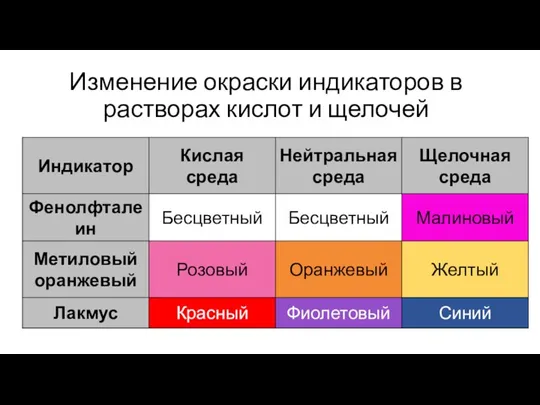
- 20. Изменение окраски индикаторов в растворах кислот и щелочей
- 21. Изменение окраски индикатора Обесцвечивание чайной заварки при добавлении лимона; Натуральные индикаторы, содержащиеся в соках ягод и
- 22. 5. Взаимодействие с нерастворимыми основаниями раствор кислоты + основание = соль металла + вода 3HNO3 +
- 23. 6. Взаимодействие с солями раствор кислоты + основный оксид = соль металла + вода H2SO4 +
- 24. Выполните задание 1 На стол пролили 10 мл раствора серной кислоты (ρ = 1,15 г/см3, 21%).
- 25. Выполните задание 2 S → ? → SO3 → H2SO4 → нерастворимая соль Решение: 2S +
- 27. Скачать презентацию

















 Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Закон сохранения массы веществ. 8 класс
Закон сохранения массы веществ. 8 класс Золото (Au)
Золото (Au) Презентация на тему Важнейшие классы неорганических соединений
Презентация на тему Важнейшие классы неорганических соединений  Строение атома
Строение атома Rozcieńczanie i zatężanie roztworów
Rozcieńczanie i zatężanie roztworów Порох: из грязи в князи
Порох: из грязи в князи Полимеры. Полиэтилен
Полимеры. Полиэтилен Металлы
Металлы Свойства кислот, оснований и солей как электролитов
Свойства кислот, оснований и солей как электролитов Соединения щелочноземельных металлов
Соединения щелочноземельных металлов Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия
Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия Общая характеристика элементов VII группы главной подгруппы. Хлор
Общая характеристика элементов VII группы главной подгруппы. Хлор Алкены
Алкены Презентация на тему Знаки химических элементов
Презентация на тему Знаки химических элементов  Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Презентация на тему Круговорот углерода в природе
Презентация на тему Круговорот углерода в природе  Чугуны
Чугуны Взаимодействие с водой
Взаимодействие с водой Серная кислота
Серная кислота Понятие о полимерах
Понятие о полимерах Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад
Открытый урок по химии в 8 классе по теме: «Первоначальные химические понятия». Учитель химии ГБОУ СОШ № 650 Безверхова Олеся Влад Аппаратура ионообменных процессов
Аппаратура ионообменных процессов Primenenie_kauchukov
Primenenie_kauchukov Строение воды
Строение воды Проблемное обучение на уроках химии
Проблемное обучение на уроках химии Карбоновые кислоты
Карбоновые кислоты Фосфорорганические соединения
Фосфорорганические соединения