Содержание
- 2. Основные типы химических реакций
- 3. Основные типы химических реакций 1. Взаимодействие кислот с основаниями.
- 4. Основные типы химических реакций 1. Взаимодействие кислот с основаниями. 2. Взаимодействие кислот с оксидами металлов.
- 5. Основные типы химических реакций 1. Взаимодействие кислот с основаниями. 2. Взаимодействие кислот с оксидами металлов. 3.
- 6. Основные типы химических реакций 1. Взаимодействие кислот с основаниями. 2. Взаимодействие кислот с оксидами металлов. 3.
- 7. Взаимодействие кислот с основаниями KOH
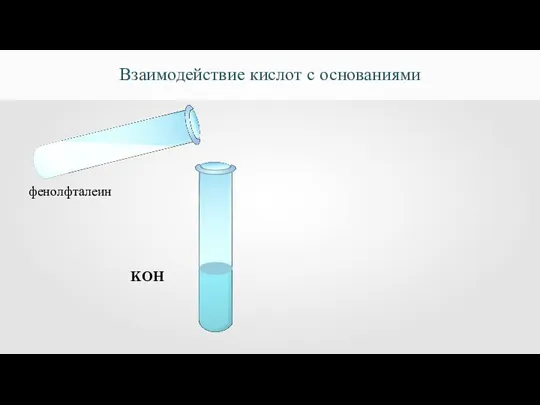
- 8. Взаимодействие кислот с основаниями KOH фенолфталеин
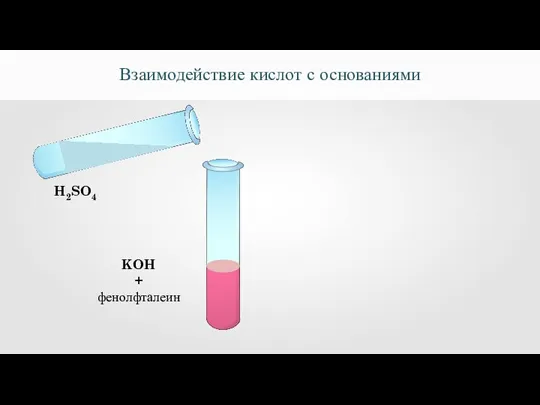
- 9. Взаимодействие кислот с основаниями KOH фенолфталеин KOH + фенолфталеин
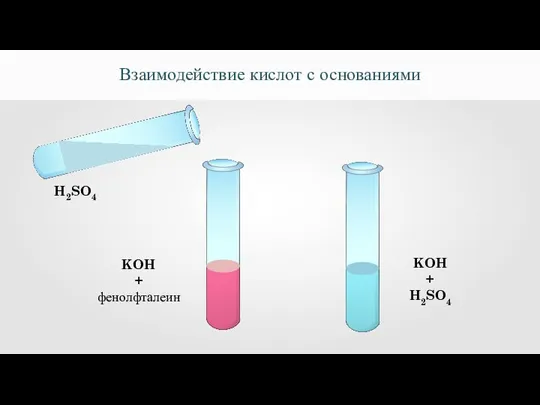
- 10. Взаимодействие кислот с основаниями H2SO4 KOH + фенолфталеин
- 11. Взаимодействие кислот с основаниями H2SO4 KOH + фенолфталеин KOH + H2SO4
- 12. Взаимодействие кислот с основаниями KOH + H2SO4 Н2SO4 + 2KOH = K2SO4 + 2H2O
- 13. Взаимодействие кислот с основаниями KOH + H2SO4 Н2SO4 + 2KOH = K2SO4 + 2H2O Н +
- 14. Взаимодействия серной кислоты с гидроксидом калия Н2SO4 + 2KOH = K2SO4 + 2H2O Реакции нейтрализации —
- 15. Взаимодействие кислот с нерастворимыми основаниями
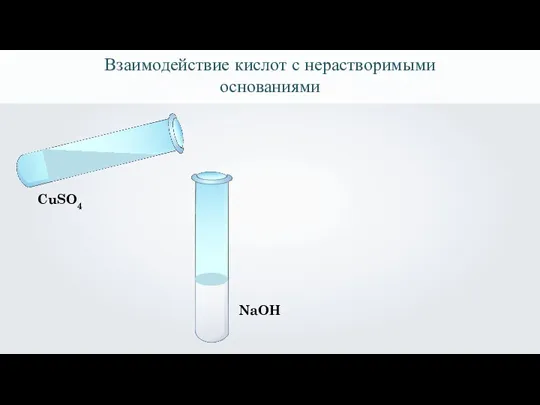
- 16. NaOH Взаимодействие кислот с нерастворимыми основаниями
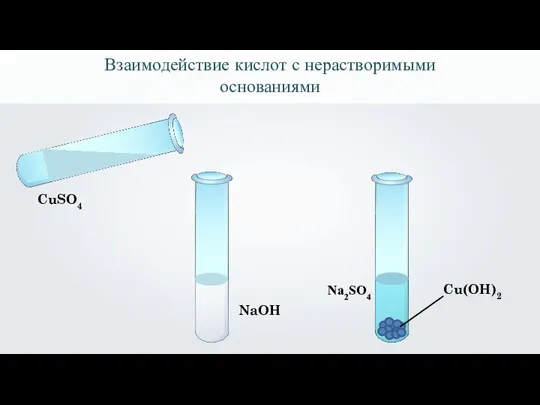
- 17. NaOH Взаимодействие кислот с нерастворимыми основаниями CuSO4
- 18. NaOH Взаимодействие кислот с нерастворимыми основаниями CuSO4 Cu(OH)2 Na2SO4
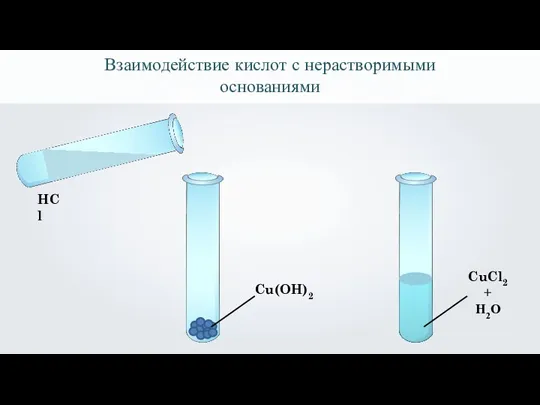
- 19. Взаимодействие кислот с нерастворимыми основаниями Cu(OH)2
- 20. Взаимодействие кислот с нерастворимыми основаниями Cu(OH)2 HCl
- 21. Взаимодействие кислот с нерастворимыми основаниями Cu(OH)2 HCl CuCl2 + H2O
- 22. Взаимодействие кислот с нерастворимыми основаниями CuCl2 + H2O 2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4 Cu2+
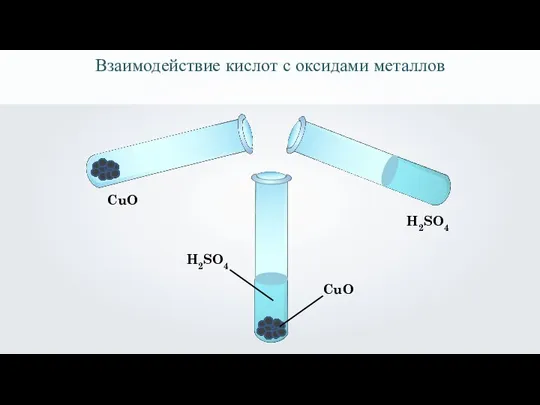
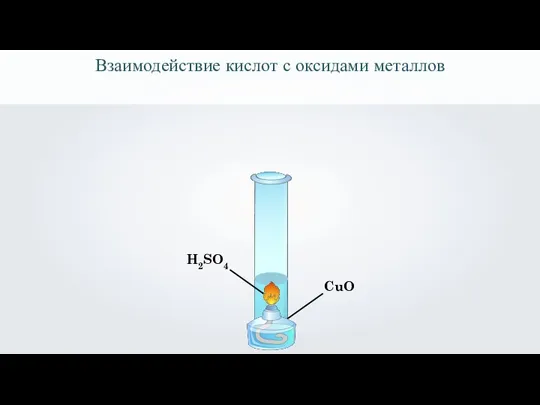
- 23. CuO H2SO4 CuO Cu(OH)2 H2SO4 Взаимодействие кислот с оксидами металлов
- 24. Взаимодействие кислот с оксидами металлов
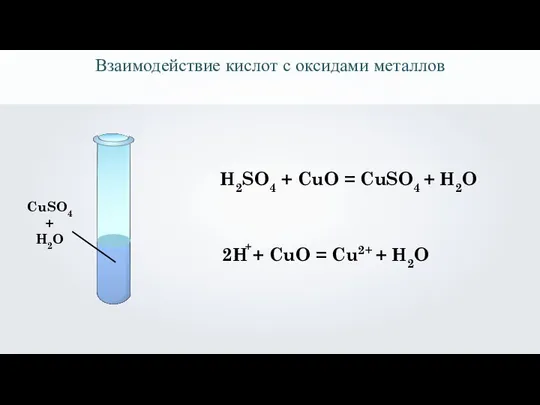
- 25. CuSO4 + H2O Взаимодействие кислот с оксидами металлов
- 26. CuSO4 + H2O H2SO4 + CuO = CuSO4 + H2O 2H + CuO = Cu2+ +
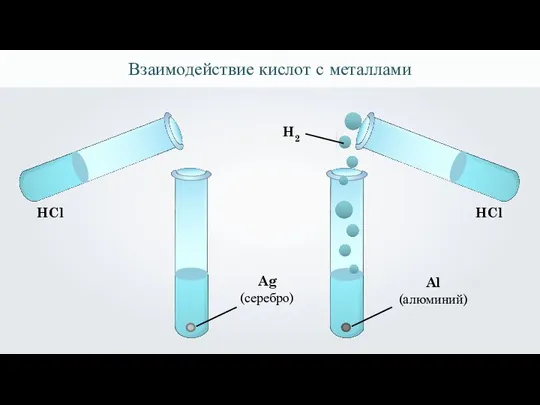
- 27. Взаимодействие кислот с металлами Условия протекания этого типа реакций. 1. Металл, взаимодействующий с кислотой, должен находиться
- 28. Взаимодействие кислот с металлами Ag (серебро) Al (алюминий) HCl HCl H2
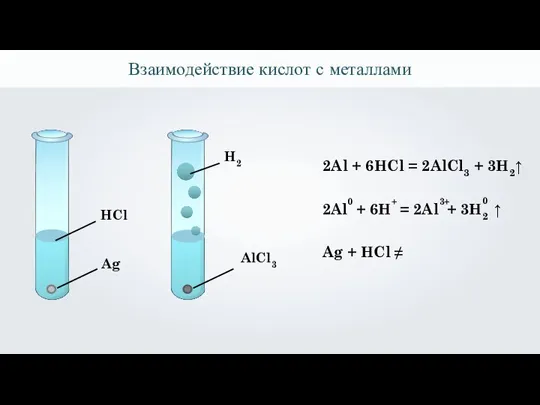
- 29. Взаимодействие кислот с металлами Ag AlCl3 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 6H
- 30. Взаимодействие кислот с металлами Ряд напряжений металлов: K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn,
- 31. Взаимодействие кислот с металлами Условия протекания этого типа реакций. 2. В результате реакции должна получиться растворимая
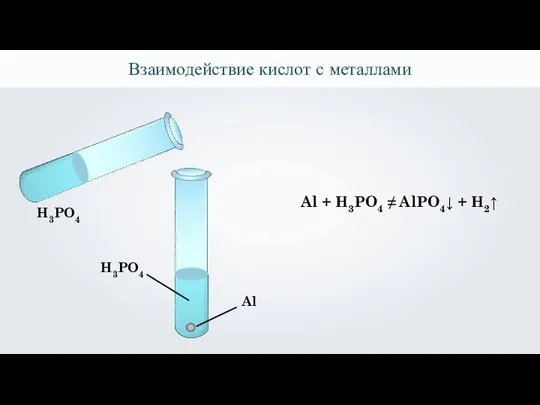
- 32. Взаимодействие кислот с металлами Al H3PO4 Al + H3PO4 ≠ AlPO4↓ + H2↑ H3PO4
- 33. Взаимодействие кислот с металлами Условия протекания этого типа реакций.
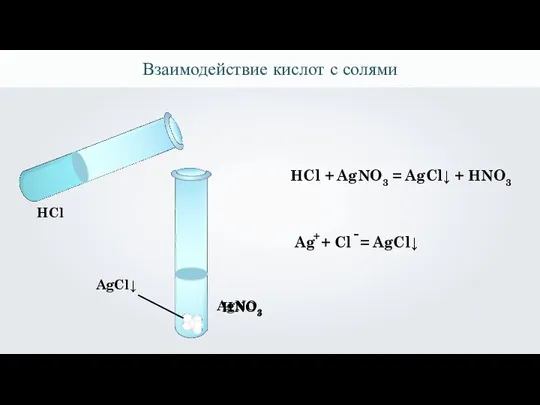
- 34. Взаимодействие кислот с солями AgNO3 HCl HCl + AgNO3 = AgCl↓ + HNO3 Ag + Cl
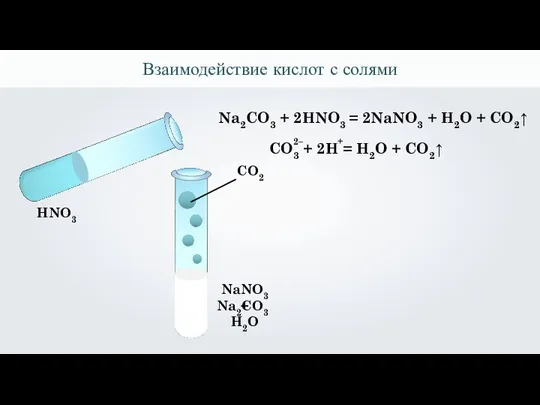
- 35. Взаимодействие кислот с солями Na2CO3 HNO3 NaNO3 + H2O CO2 Na2CO3 + 2HNO3 = 2NaNO3 +
- 37. Скачать презентацию



















 Непредельные углеводороды
Непредельные углеводороды Строение атома
Строение атома Презентация на тему Количество вещества. Молярная масса
Презентация на тему Количество вещества. Молярная масса  Водород
Водород Химические свойства
Химические свойства Вероятность протекания химических реакций
Вероятность протекания химических реакций Уран гексафториді
Уран гексафториді Синтез.Малахит
Синтез.Малахит Химическая связь. Строение вещества
Химическая связь. Строение вещества Химические элементы, входящие в состав питательных веществ
Химические элементы, входящие в состав питательных веществ Характеристика химических элементов IV А группа. Углерод
Характеристика химических элементов IV А группа. Углерод Исследование физико-химических свойств растворов сахарозы
Исследование физико-химических свойств растворов сахарозы Электролиз. Задания
Электролиз. Задания Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов
Методы пробоотбора и пробоподготовки донных отложений, почв и грунтов Использование информационноко-ммуникационных технологий по формированию УУД на уроках химии
Использование информационноко-ммуникационных технологий по формированию УУД на уроках химии Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Строение вещества
Строение вещества Алкины
Алкины 10 класс урок № 2 ТХС
10 класс урок № 2 ТХС Stroenie_atoma__1
Stroenie_atoma__1 Физические свойства водорода
Физические свойства водорода Основы химии полимеров
Основы химии полимеров Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Полимердің тұтқырлық серпімді қасиеттері
Полимердің тұтқырлық серпімді қасиеттері Эмульсия. Основные типы эмульсий
Эмульсия. Основные типы эмульсий Самостоятельная работа
Самостоятельная работа Соединения галогенов
Соединения галогенов Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений