Содержание
- 2. Ацетилен был открыт в 1836 г. Э. Дэви в светильном газе. Алкины – углеводороды ациклического ряда,
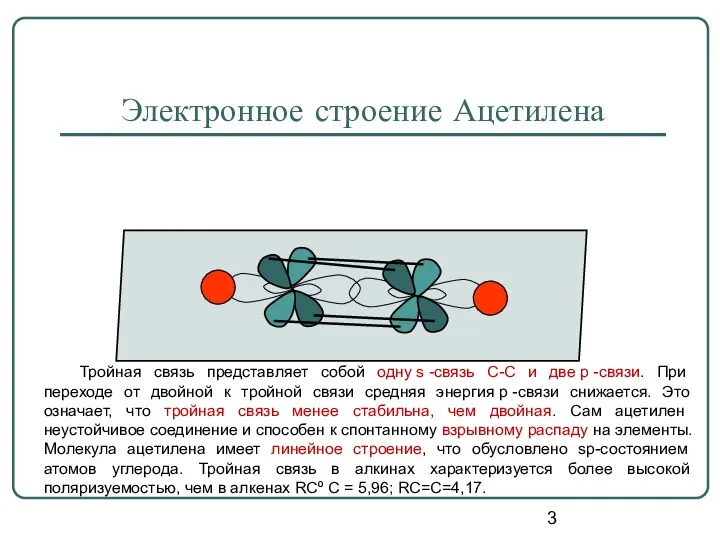
- 3. Электронное строение Ацетилена Тройная связь представляет собой одну s -связь С-С и две p -связи. При
- 4. Физические свойства алкинов Алкины представляют собой бесцветные газы или жидкости. Начиная с С17, алкины являются кристаллическими
- 5. Изомерия и номенклатура Согласно IUPAC названия алкинов образуют, заменяя в названиях алканов суффикс “-ан” на “-ин”.
- 6. В рациональной номенклатуре замещенные алкины рассматриваются как производные ацетилена: Этин (Ацетилен) Пропин (Метилацетилен) 2-Бутин (Диметилацетилен) Структурная
- 7. Способы получения Получение из простых веществ (М. Бертло, XIX век) Промышленные способы: Крекинг метана Каталитическое взаимодействие
- 8. Способы получения Реакции пиролиза метана или этана 2CH4 C2H2 + 3H2 CH3 - CH3 C2H2 +
- 9. Способы получения Карбидный метод CaC2 + 2H2O C2H2 + Ca(OH)2 Аналогично реагируют карбиды стронция и бария
- 10. Способы получения Реакции нуклеофильного отщепления дигалогеналканов и моногалогеналкенов CH3-CHBr-CH2Br + 2NaOH CH3-C≡CH + 2NaBr + 2H2O
- 11. Способы получения Алкилирование алкинов Реакции проводятся через синтез ацетиленидов а) R-C≡CH + NaNH2 R-C≡C-Na+ + NH3
- 12. Химические свойства Реакции присоединения По механизму АЕ : галогеннирование, гидрогалогенирование, гидратация (реакция Кучерова), Присоединение карбоновых кислот,
- 14. Скачать презентацию










 Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия
Положение кислорода и серы в Периодической системе химических элементов, строение атомов. Строение простых веществ. Аллотропия Реакции разложения
Реакции разложения Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А.
Химические явления. Горение. Презентация по природоведению для 5 класса Подготовила Шашлова Т.А. Органическая геохимия
Органическая геохимия Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Подгруппа алюминия
Подгруппа алюминия Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро
Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро Химическое ассорти
Химическое ассорти Галогены
Галогены Презентация на тему Кислоты
Презентация на тему Кислоты  Презентация по Химии "Фиолетовый проказник"
Презентация по Химии "Фиолетовый проказник"  Презентация на тему: Изомерия
Презентация на тему: Изомерия Карбоновые кислоты
Карбоновые кислоты Алканы. Строение и изомерия
Алканы. Строение и изомерия ТЕСТ "Дисперсные системы"
ТЕСТ "Дисперсные системы" Окислительно-восстановительные реакции. Лекция №7
Окислительно-восстановительные реакции. Лекция №7 Алканы
Алканы Физическая химия, термодинамика
Физическая химия, термодинамика Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Общая характеристика металлов
Общая характеристика металлов Щелочноземельные металлы
Щелочноземельные металлы Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Якісні реакції органічних речовин
Якісні реакції органічних речовин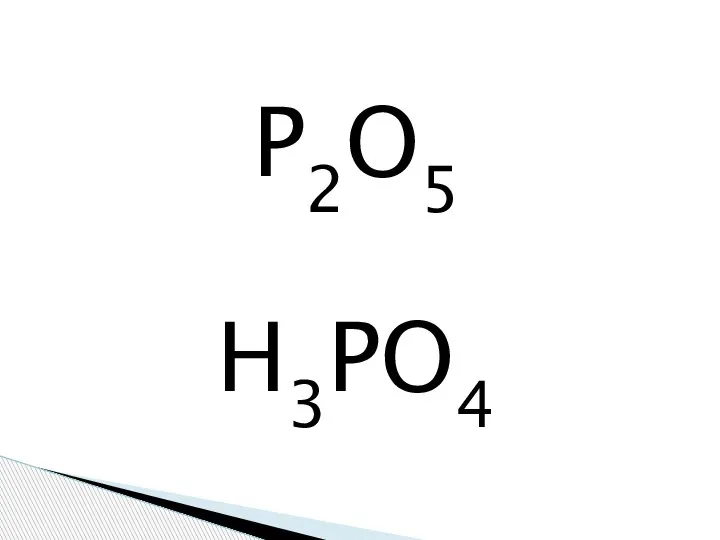 Фосфорная кислота
Фосфорная кислота Липиды. Состав липидов
Липиды. Состав липидов Безопасно ли пить воду из водопроводного крана?
Безопасно ли пить воду из водопроводного крана? Gelation in aqueous solution of L-cysteine and silver nitrate
Gelation in aqueous solution of L-cysteine and silver nitrate