Содержание
- 2. Какая химическая связь называется ионной? Что такое ион? Как образуется положительный и отрицательный ион? В чем
- 3. ИЗ ПЕРЕЧИСЛЕННЫХ ФОРМУЛ ВЕЩЕСТВ ВЫБЕРИТЕ ВЕЩЕСТВА С ИОННОЙ СВЯЗЬЮ и составьте схемы их образования KCl H2
- 4. Какие вещества остались? H2 F2 HCl Какими элементами они образованы?
- 5. ПРОБЛЕМА !!! Н₂, F₂, О₂, HCl, Н₂О, NН₃…? Каким образом атомы удерживаются друг возле друга в
- 6. Какой вид связи мы можем ожидать при образовании соединений между атомами неметаллов?
- 7. Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей
- 8. КОВАЛЕНТНАЯ ХИМИЧЕСКАЯ СВЯЗЬ
- 9. Ковалентной или атомной называется химическая связь, возникающая в результате образования общих электронных пар непарных внешних электронов.
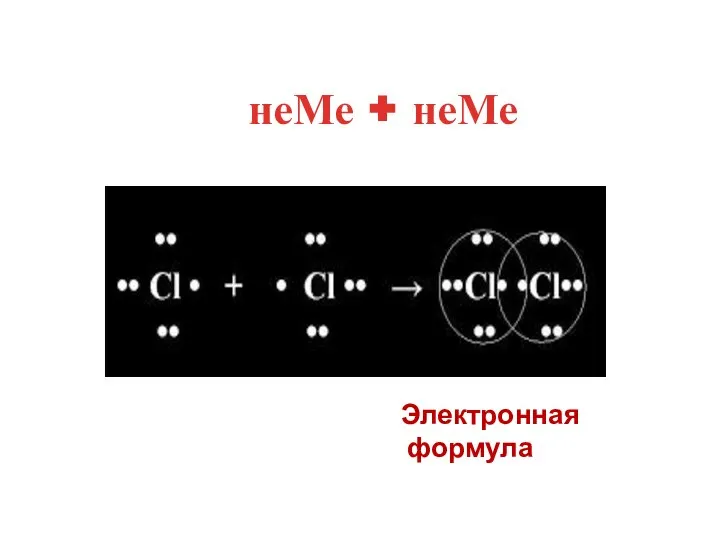
- 10. неМе + неМе Электронная формула
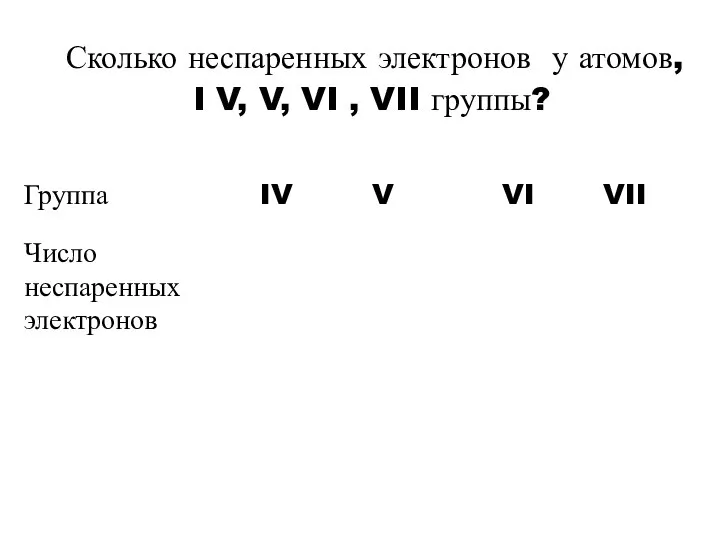
- 11. Как определяется число валентных и неспаренных электронов? Число неспаренных электронов = 8-номер группы
- 12. Сколько неспаренных электронов у атомов, I V, V, VI , VII группы?
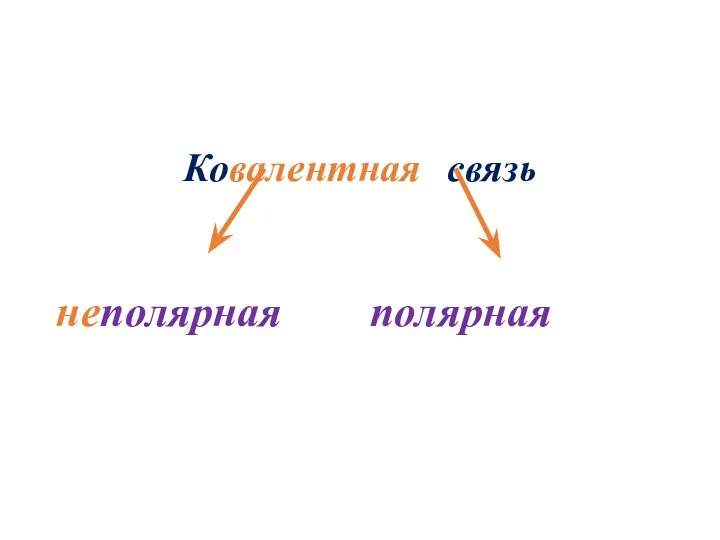
- 13. Ковалентная связь неполярная полярная
- 14. Ковалентная неполярная связь
- 15. Ковалентной неполярной называется связь, которая возникает между одинаковыми неметаллами ( в простых веществах неметаллах) : Сl2,
- 16. Как составить электронные схемы образования молекул: Сl2, H2, N2, О2?
- 17. АЛГОРИТМ составления схемы 1.Определить валентные электроны . 2.Определить количество неспаренных электронов. 3. Валентные электроны каждого атома
- 18. 3.Показать взаимодействие атомов, •• •• •• •• ׃Cl • + • Cl ׃ = ׃Cl ׃
- 19. Oдинарная связь – это ковалентная связь, которая образована одной электронной парой. Н – Н Cl-Cl двойная
- 20. Задание. Пользуясь алгоритмом, составить cхемы образования ковалентных связей в молекулах кислорода О2 и азота N2.
- 21. ОТВЕТ:
- 22. Ковалентная полярная связь
- 23. А как же образуются молекулы из атомов разных неметаллов ( сложных веществ): HСl ,HF, Н₂О, Н₂S,
- 24. Способность атомов химических элементов оттягивать к себе общие электронные пары, называется электроотрицательностью (ЭО)
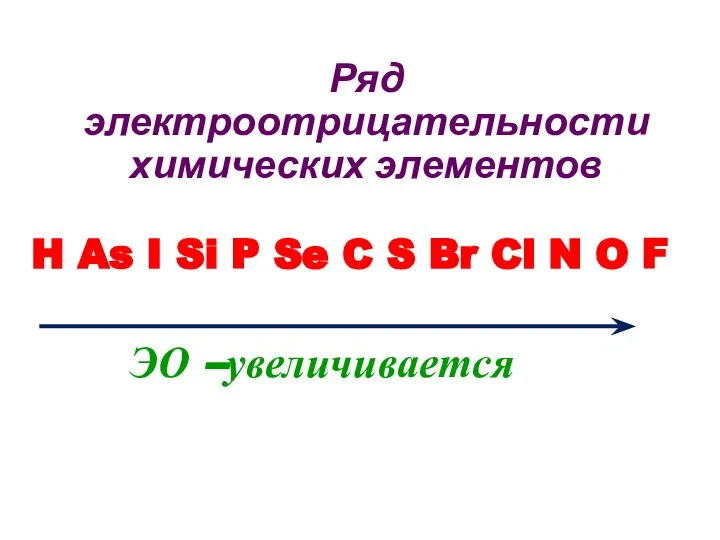
- 25. Ряд электроотрицательности химических элементов H As I Si P Se C S Br Cl N O
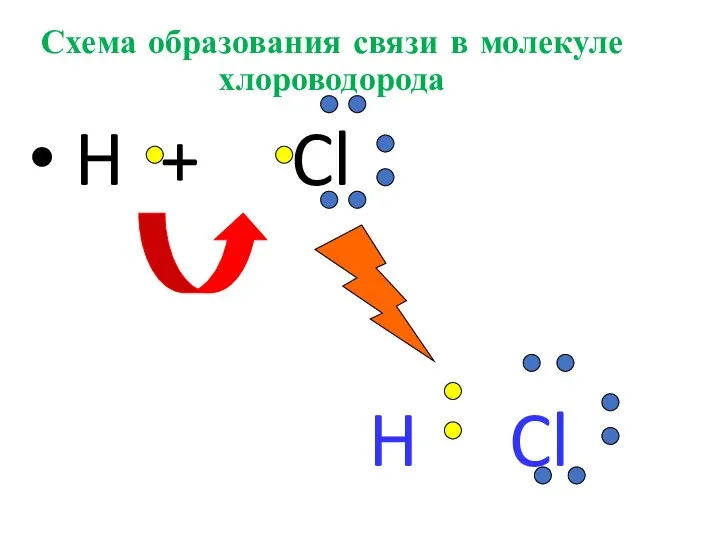
- 26. Схема образования связи в молекуле хлороводорода H + Cl H Cl
- 27. Изобразить схему образования связи в молекуле хлорводорода HCl ; •• •• H• + • Cl ׃
- 28. Разумеется, атомы менее ЭО будут иметь избыточный положительный заряд, т.е. будут представлять собой как бы положительный
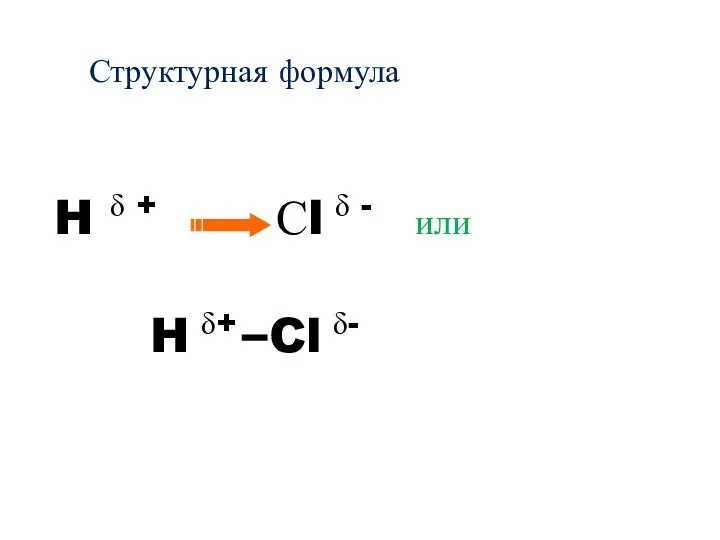
- 29. Структурная формула H δ + Сl δ - или H δ+ Cl δ-
- 30. Алгоритм составления схемы 1. Определим число электронов на внешнем энергетическом уровне у атомов неметаллов и число
- 31. Домашнее задание 1.Составьте электронную схему строения атома серы. 2. Подчеркните валентные электроны и обозначьте их точками
- 33. Скачать презентацию
























 Различные виды красителей
Различные виды красителей Взвешивание. Аналитические весы
Взвешивание. Аналитические весы Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова Основные сведения о металлах и сплавах и их свойства
Основные сведения о металлах и сплавах и их свойства Водород, его общая характеристика, нахождение в природе и его свойства
Водород, его общая характеристика, нахождение в природе и его свойства Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины
Формирование полимерной структуры при отверждении олигомеров. Каучуки и резины 4.1-2 Генетическая связь+
4.1-2 Генетическая связь+ Степень окисления
Степень окисления Многообразие органических веществ
Многообразие органических веществ Коррозия металлов. Лекция №8
Коррозия металлов. Лекция №8 Презентация на тему Подгруппа кислорода
Презентация на тему Подгруппа кислорода  Слідство ведуть знавці
Слідство ведуть знавці Электроосмос. Практическое применение электроосмоса
Электроосмос. Практическое применение электроосмоса Век медный, бронзовый, железный
Век медный, бронзовый, железный Роль М.В Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения.
Роль М.В Ломоносова и Дж.Дальтона в создании атомно-молекулярного учения. ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски
ИКТ на уроках химии. Часть 1. Теория и практика применения интерактивной доски Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Положение металлов в Периодической системе химических элементов Д.И.Менделеева
Положение металлов в Периодической системе химических элементов Д.И.Менделеева Алюминий и его соединения
Алюминий и его соединения Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Phosphorus
Phosphorus Относительная атомная масса Урок 8 класс Учитель химии Чиркунова Л.А.
Относительная атомная масса Урок 8 класс Учитель химии Чиркунова Л.А. Щелочные металлы
Щелочные металлы Аварийно-химически опасное вещество (АХОВ)
Аварийно-химически опасное вещество (АХОВ) Хром (Cr)
Хром (Cr) Виртуальная химическая лаборатория
Виртуальная химическая лаборатория Химические свойства и получение насыщенных одноатомных спиртов
Химические свойства и получение насыщенных одноатомных спиртов