Содержание
- 2. Правила вычисления степени окисления (СО) элементов:
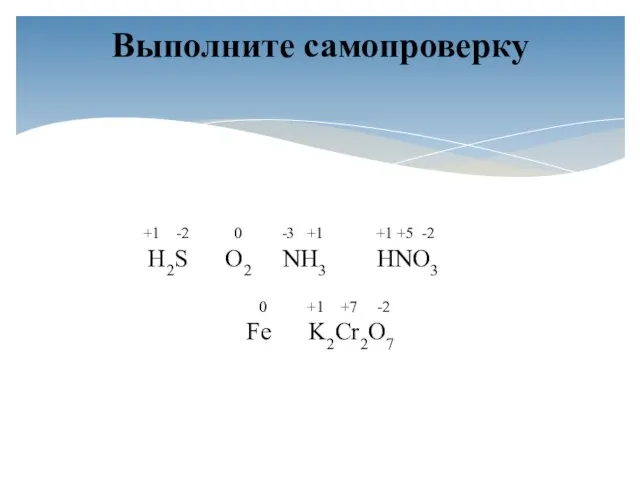
- 3. Определите степени окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7
- 4. +1 -2 0 -3 +1 +1 +5 -2 H2S O2 NH3 HNO3 0 +1 +7 -2
- 5. Определите, что происходит со степенью окисления серы при следующих переходах: А) H2S → SO2 → SO3
- 6. А) H2S-2 → S+4 O2 → S+6 O3 Б) S+4 O2→ H2S+4 O3 → Na2S+4O3 В
- 7. Окислительно-восстановительные реакции (ОВР) – реакции, которые протекают с изменением степени окисления атомов, входящих в состав реагирующих
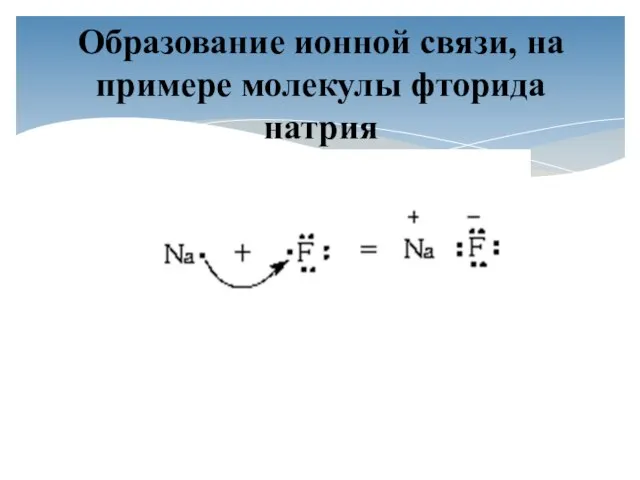
- 8. Образование ионной связи, на примере молекулы фторида натрия
- 9. Что можно сказать о завершённости внешнего уровня атомов фтора и натрия? Какому атому легче принять, а
- 10. Окисление – процесс отдачи электронов атомом. Окислитель – атом, принимающий электроны и понижающий свою степень окисления,
- 11. 1. Посмотрите анимацию. 2. Изучите алгоритм составления уравнений ОВР методом электронного баланса (в папке). РАССТАНОВКА КОЭФФИЦИЕНТОВ
- 12. Расставьте коэффициенты в УХР Al2O3 + H2 = H2O + Al методом электронного баланса, укажите процессы
- 14. Скачать презентацию









 Пластмассы и их свойства
Пластмассы и их свойства Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме Разложение отходов. 11 класс
Разложение отходов. 11 класс Строение, свойства, биологическая роль дезоксисахаров и аминосахаров
Строение, свойства, биологическая роль дезоксисахаров и аминосахаров Алканы. Строение,номенклатура, изомерия
Алканы. Строение,номенклатура, изомерия Основания Сложные вещества
Основания Сложные вещества Количественный анализ
Количественный анализ Соли (8 класс)
Соли (8 класс) Свойства воды. СВФ
Свойства воды. СВФ Презентация на тему Железо 9 класс
Презентация на тему Железо 9 класс  Получение и применение кислорода. Круговорот кислорода в природе
Получение и применение кислорода. Круговорот кислорода в природе Кислород. 8 класс
Кислород. 8 класс Кремний и его соединения
Кремний и его соединения Презентация на тему Факторы, влияющие на скорость химической реакции
Презентация на тему Факторы, влияющие на скорость химической реакции  Химическая связь
Химическая связь Валентность
Валентность Полисахариды
Полисахариды Круговорот серы в природе
Круговорот серы в природе Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Классификация НПВС (по химической структуре активности)
Классификация НПВС (по химической структуре активности) Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа Презентация на тему Этиловый спирт и его влияние на организм человека
Презентация на тему Этиловый спирт и его влияние на организм человека  Моносахариды
Моносахариды Свойства радиоактивных элементов
Свойства радиоактивных элементов Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Структура металлов, сплавов, интерметаллидов и квазикристаллов
Структура металлов, сплавов, интерметаллидов и квазикристаллов РАСЧЕТЫ по химическим уравнениям
РАСЧЕТЫ по химическим уравнениям Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства