Содержание
- 2. Атомы химических элементов изменяют степень окисления
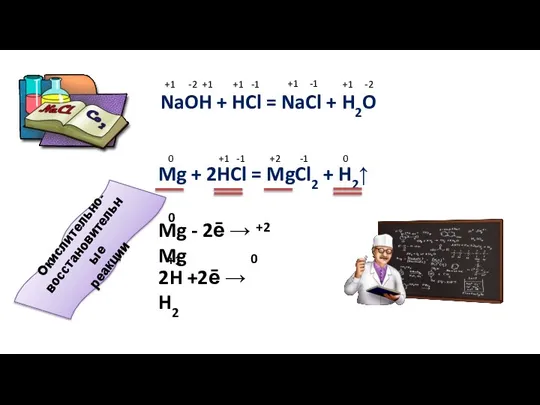
- 3. NaOH + HCl = NaCl + H2O -1 -2 +1 +1 -1 +1 -1 +1 -2
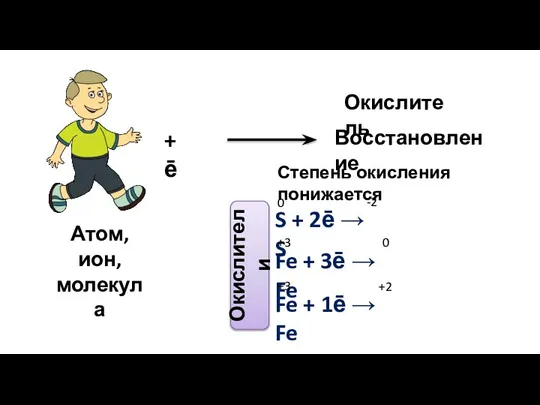
- 4. Атом, ион, молекула + ē Восстановление Степень окисления понижается S + 2ē → S 0 -2
- 5. Атом, ион, молекула - ē Окисление Степень окисления повышается Восстановитель Са - 2ē → Са 0
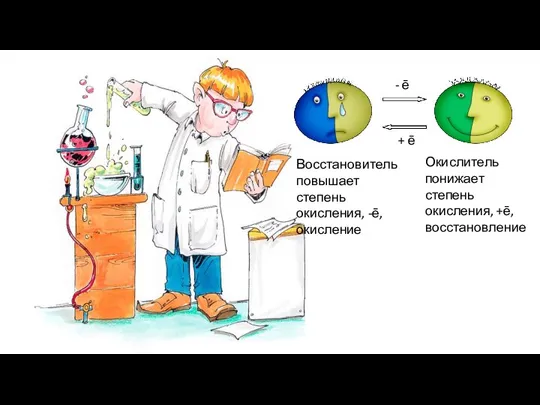
- 6. - ē + ē Восстановитель повышает степень окисления, -ē, окисление Окислитель понижает степень окисления, +ē, восстановление
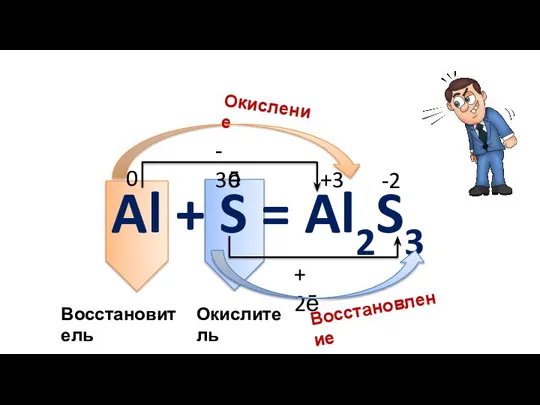
- 7. Al + S = Al2S3 0 +3 - 3ē Восстановитель Окисление 0 -2 + 2ē Окислитель
- 8. Al + S → Al2S3 0 0 +3 -2 Al - 3ē → Al 2 восстановитель;
- 9. Ag + HNO3 → AgNO3 + NO↑ + H2O 0 +1 +5 -2 +1 +5 -2
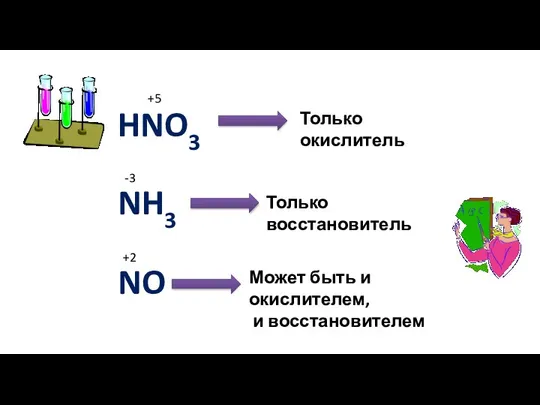
- 10. HNO3 +5 Только окислитель NH3 -3 Только восстановитель NO +2 Может быть и окислителем, и восстановителем
- 12. Скачать презентацию




 Кремнийорганические каучуки
Кремнийорганические каучуки Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Конкурс проектных работ Химический элемент … – и это все о нем
Конкурс проектных работ Химический элемент … – и это все о нем Химические реакции
Химические реакции Разработка реактора для отопления домов путем извлечения водорода из воды
Разработка реактора для отопления домов путем извлечения водорода из воды Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Классификация органических соединений
Классификация органических соединений Химическая формула
Химическая формула Аналитическая химия
Аналитическая химия Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого
Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого Dereglarea metabolismului
Dereglarea metabolismului Сравнение активностей металлов
Сравнение активностей металлов Применение солей
Применение солей 12_BROMATOMETRIYa_NITRITOMETRIYa
12_BROMATOMETRIYa_NITRITOMETRIYa Ліпіди
Ліпіди Синтетический каучук
Синтетический каучук Сталь. Свойства стали
Сталь. Свойства стали Презентация на тему Получение радиоактивных изотопов и их применение
Презентация на тему Получение радиоактивных изотопов и их применение  Аллотропия углерода
Аллотропия углерода Электролиты. Химический диктант (9 класс)
Электролиты. Химический диктант (9 класс) Открытия в химии
Открытия в химии Звездный час. Знатоки химии
Звездный час. Знатоки химии Сероводород
Сероводород Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера
Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера Электролиз
Электролиз