Содержание
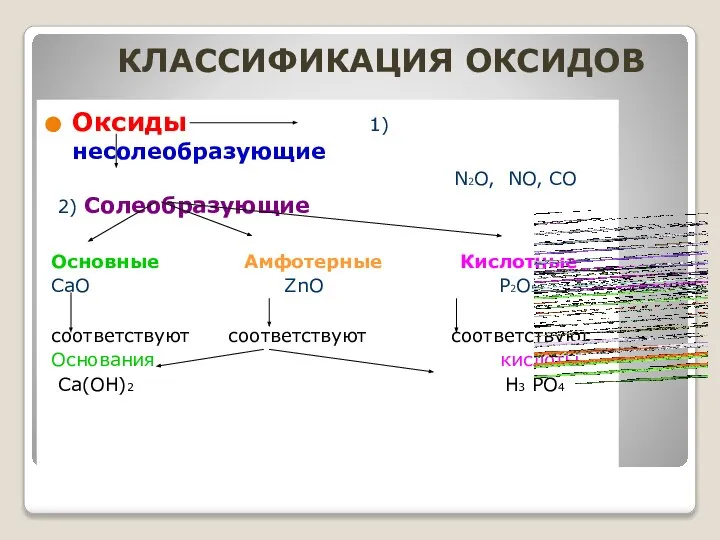
- 2. КЛАССИФИКАЦИЯ ОКСИДОВ Оксиды 1) несолеобразующие N2O, NO, CO 2) Солеобразующие Основные Амфотерные Кислотные CaO ZnO P2O5
- 3. Кислотные оксиды Кислотные оксиды - это оксиды, которые реагируют со щелочами с образованием соли и воды,
- 4. Основные оксиды Основные оксиды - это оксиды, которые реагируют с кислотами с образованием соли и воды,
- 5. Физические свойства
- 7. Амфотерные оксиды Эти оксиды проявляют двойные свойства, т.е свойства и кислотных, и основных оксидов. Значит, они
- 8. Несолеобразующие безразличные оксиды не реагируют с образованием солей ни с кислотами, ни со щелочами. К такому
- 9. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.) 1) О.О. + кислота =соль + вода (реакция обмена) CaO +
- 10. Химические свойства 4. Взаимодействие с амфотерными оксидами: СaO + Al2O3 → Сa(AlO2)2 5.Многие основные оксиды могут
- 11. Химические свойства Оксиды благородных металлов и ртути разлагаются при нагревании: 2Ag2O → 4Ag + O2 2HgO
- 12. Тренировочные упражнения
- 14. Скачать презентацию










 Презентация на тему Химия наука о веществах
Презентация на тему Химия наука о веществах  Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co
Установка плазмохимического синтеза по схеме плазменной переконденсации на примере переработки механической смеси tic-mo-co Степени окисления и формулы веществ
Степени окисления и формулы веществ Викторина Важнейшие классы веществ. Химические реакции. 8 класс
Викторина Важнейшие классы веществ. Химические реакции. 8 класс 热塑性复合材料的分类及特性
热塑性复合材料的分类及特性 Природные источники углеводородов. Нефть и природный газ
Природные источники углеводородов. Нефть и природный газ Концентрации растворов и эквиваленты веществ
Концентрации растворов и эквиваленты веществ 1.2. Измерения веществ
1.2. Измерения веществ Препараты гормонов стероидной структуры
Препараты гормонов стероидной структуры Углерод. 9 класс
Углерод. 9 класс Силикаты
Силикаты Металлы. Определения
Металлы. Определения Химические свойства оксидов
Химические свойства оксидов Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5)
Материаловедение. Влияние нагрева на структуру деформированного металла. (Тема 5) Кислород. Общая характеристика подгруппы на примере кислорода и серы
Кислород. Общая характеристика подгруппы на примере кислорода и серы Газообразные дисперсные системы (Аэрозоли)
Газообразные дисперсные системы (Аэрозоли) Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Презентация на тему Предельные одноатомные спирты
Презентация на тему Предельные одноатомные спирты  Начало репликации. Направление движения вилки репликации
Начало репликации. Направление движения вилки репликации Щелочные металлы
Щелочные металлы Органическая химия: пищевые добавки
Органическая химия: пищевые добавки Определение плотности газообразного вещества по плотности
Определение плотности газообразного вещества по плотности Химические свойства
Химические свойства Предмет органической химии
Предмет органической химии Электронная структура атомов
Электронная структура атомов Дивный мир турмалинов
Дивный мир турмалинов Аппаратура ионообменных процессов
Аппаратура ионообменных процессов