Содержание
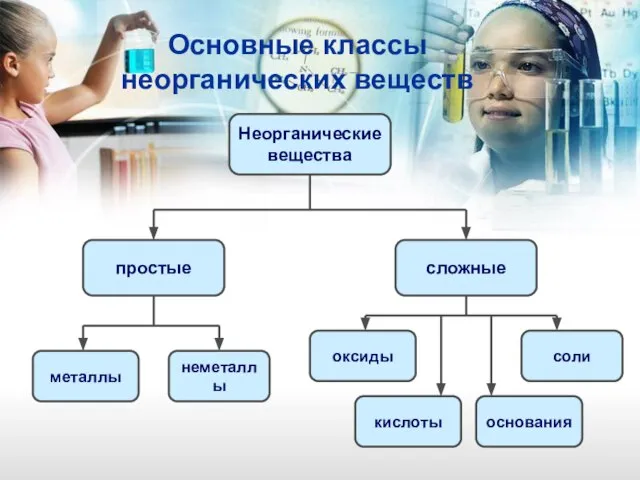
- 2. Основные классы неорганических веществ
- 3. «Оксиды»
- 4. Оксиды – это сложные вещества, в состав которых входят атомы двух химических элементов, один из которых
- 5. Алгоритм определения оксида Состав: два элемента На втором месте: кислород Валентность кислорода - 2 CaO, Mn2O7,
- 6. Названия оксидов: Начинать с кислорода – «Оксигениум» Оставляем «Окс» + суффикс «ид» = оксид Добавляем русское
- 7. Валентность элементов в высших оксидах равна номеру группы в Периодической таблице! Формулу высшего оксида для элементов
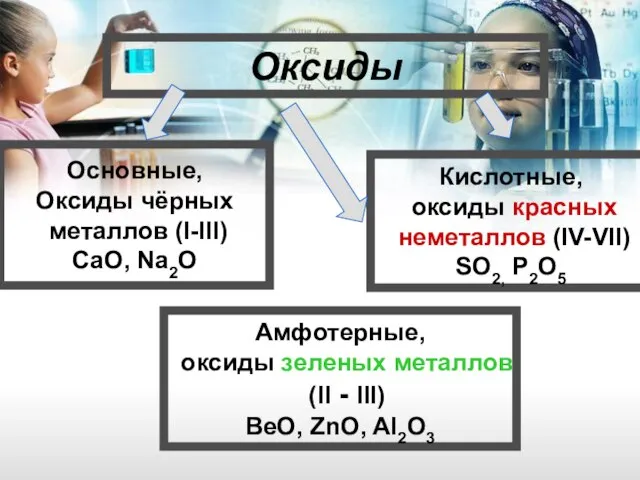
- 8. Оксиды Основные, Оксиды чёрных металлов (I-III) CaO, Na2O Кислотные, оксиды красных неметаллов (IV-VII) SO2, P2O5 Амфотерные,
- 9. Примеры твёрдых оксидов: MnO2 - оксид марганца IV (черный порошок) Fe2O3 - оксид железа III (бурый
- 10. Примеры жидких оксидов: SO3 - оксид серы VI (серный ангидрид) Н2О – оксид водорода (вода) Примеры
- 11. Общая формула кислот Кислоты – это сложные вещества, в состав которых входят атомы водорода, способные замещаться
- 12. Формулу кислоты составляем по Таблице растворимости! Голова – водород с валентностью 1 (у него +) По
- 13. H+F- фтороводородная (плавиковая) H+Cl- хлороводородная (соляная) H+Br- бромоводородная H+NO2- азотистая СУФФИКСЫ! H+NO3- азотная H+2SO32- сернистая H+2SO42-
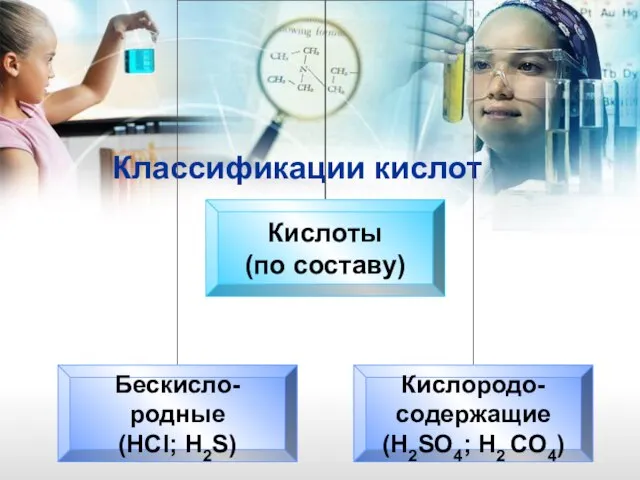
- 14. Классификации кислот
- 15. Классификации кислот
- 16. Индикатор лакмус красный Кислоту укажет ясно! Кислый вкус, окраска индикаторов – Н+ лакмус метилоранж фенолфталеин
- 17. Основания - это сложные вещества, состоящие из атомов металлов и гидроксильных групп ОН. Общая формула оснований
- 18. Формулу основания составляем по Таблице растворимости! Голова – МЕТАЛЛ с валентностью 1 - 3 (у него
- 19. Названия оснований КОН Mg(OH)2 LiOH Fe(OH)3 Ca(OH)2 Al(OH)3 гидроксид гидроксид гидроксид гидроксид гидроксид гидроксид калия магния
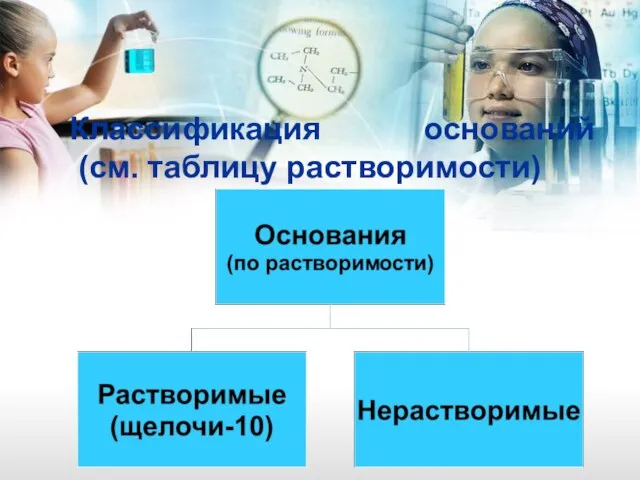
- 20. Классификация оснований (см. таблицу растворимости)
- 21. Найдите основания и разделите NaOH, H2O, Na, Na2O, NaCI, CI2, CI2O7, HCIO4, Ca(OH)2, CaCO3, CO2, Ca,
- 22. Физические свойства оснований Ba(OH)2 Co(OH)2 NaOH Ca(OH)2 LiOH Cu(OH)2
- 23. Индикатор лакмус синий – щёлочь здесь! Не будь разиней! Фенолфталеиновый в щелочах – малиновый! Изменение окраски
- 24. Общая формула СОЛИ – это сложные вещества, в состав которых входят атомы металлов и кислотные остатки.
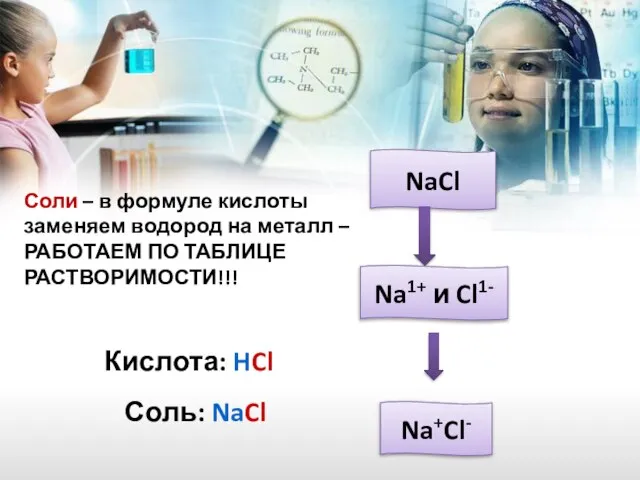
- 25. Соли – в формуле кислоты заменяем водород на металл – РАБОТАЕМ ПО ТАБЛИЦЕ РАСТВОРИМОСТИ!!! Кислота: HCl
- 26. При составлении формулы соли необходимо: Обозначить заряды ионов металла и кислотного остатка. Найти наименьшее общее кратное.
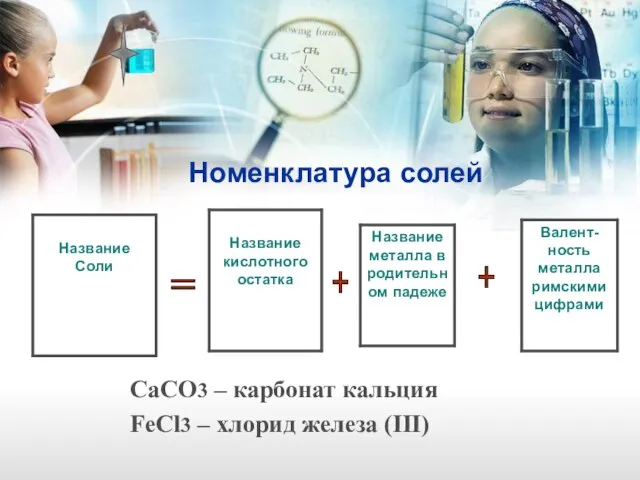
- 27. Номенклатура солей CaCO3 – карбонат кальция FeCl3 – хлорид железа (III) + + =
- 28. Кислородосодержащие (кислота – НАЯ , то суффикс – АТ, кислота – ИСТАЯ– суффикс – ИТ) NO2¯
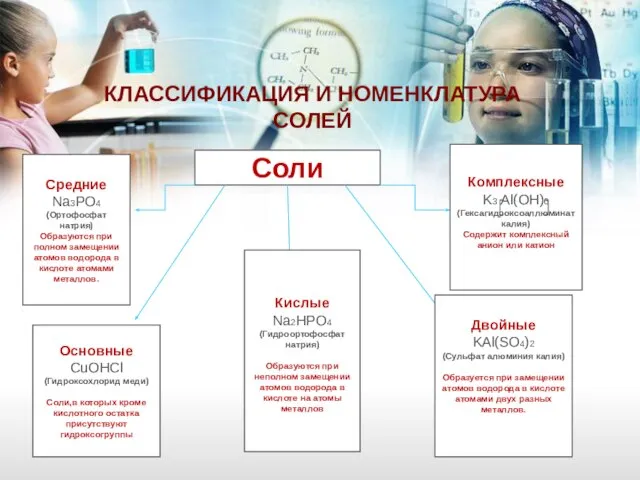
- 29. КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА СОЛЕЙ Соли Средние Na3PO4 (Ортофосфат натрия) Образуются при полном замещении атомов водорода в
- 30. Сравнение кислот и солей Сформулируйте определения кислот и солей по схемам Кислоты: Кислотные остатки; Атомы водорода;
- 31. Сравнение оснований и солей Сформулируйте определения оснований и солей по схемам Основания: Сложные вещества; Атомы металлов;
- 33. Скачать презентацию























 Физические и химические явления 8 класс Учитель химии Кузнецова А.Н.
Физические и химические явления 8 класс Учитель химии Кузнецова А.Н. Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Русские ученые- химики
Русские ученые- химики Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа
Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа Презентация на тему Коррозия
Презентация на тему Коррозия  Развитие познавательной активности творческих способностей и индивидуализация на уроках химии
Развитие познавательной активности творческих способностей и индивидуализация на уроках химии Алкины в жизни человека
Алкины в жизни человека Биотит и тальк
Биотит и тальк Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Металлическая ионная ковалентная связи
Металлическая ионная ковалентная связи Влияние метилового спирта на организм человека
Влияние метилового спирта на организм человека Будова електронних оболонок і властивості хіиічних елементів. (8 клас)
Будова електронних оболонок і властивості хіиічних елементів. (8 клас) Пропи́н (метилацетилен, аллилен)
Пропи́н (метилацетилен, аллилен) Мыс. Мыс көзі
Мыс. Мыс көзі Нуклеиновые кислоты
Нуклеиновые кислоты Водород. Вода
Водород. Вода 10_kl_klas-ya
10_kl_klas-ya Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы
Предельные углеводороды. Алканы, насыщенные углеводороды, парафины, циклоалканы Медь и ее сплавы
Медь и ее сплавы Щелочноземельные металлы
Щелочноземельные металлы Получение и химические свойства металлов
Получение и химические свойства металлов Соляная кислота и ее свойства
Соляная кислота и ее свойства Моющие и чистящие средства
Моющие и чистящие средства Аттестационная работа: Сравнение показателей качества меда разных производителей
Аттестационная работа: Сравнение показателей качества меда разных производителей 10 класс урок № 2 ТХС
10 класс урок № 2 ТХС Классификация пластмасс. Свойства и применение пластмасс
Классификация пластмасс. Свойства и применение пластмасс Применение муравьиного спирта
Применение муравьиного спирта