Содержание
- 2. Понятие об алкинах Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а
- 3. Номенклатура алкинов. (Согласно международной номенклатуре названия ацетиленовых углеводородов производят от соответствующего алкана с заменой суффикса –ан
- 4. Гомологический ряд алкинов C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин или ацетилен Пропин Бутин Пентин Гексин
- 5. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
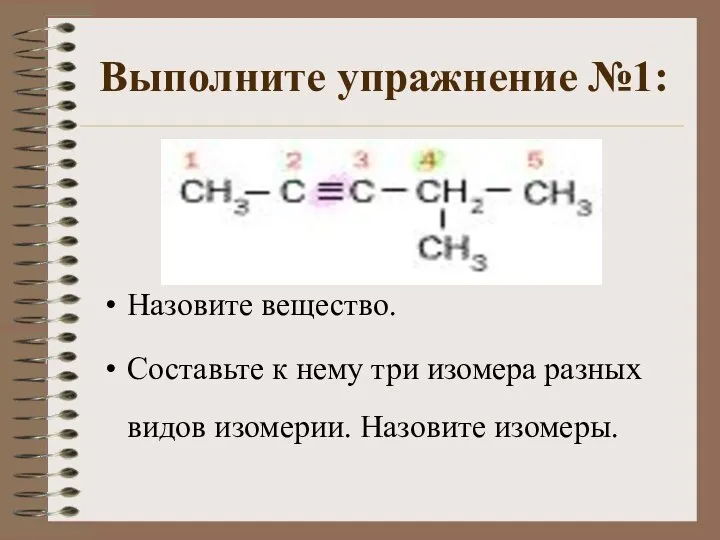
- 6. Выполните упражнение №1: Назовите вещество. Составьте к нему три изомера разных видов изомерии. Назовите изомеры.
- 7. Физические свойства Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при увеличении
- 8. Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 1500°С 2СН4 ⎯⎯→ С2Н2 + 3Н2
- 9. Химические свойства алкинов Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах
- 10. Реакции присоединения 1. Галогенирование Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды
- 11. 2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H] ⎯→ CH3−C−H ⏐ ⏐
- 12. Окисление Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
- 13. Горение ацетилена При сгорании (полном окислении) ацетилена выделяется большое количества тепла: HC≡CH + 2О2 ⎯→ 2СО2
- 14. Реакции замещения При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
- 15. Реакция полимеризации 1. Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH
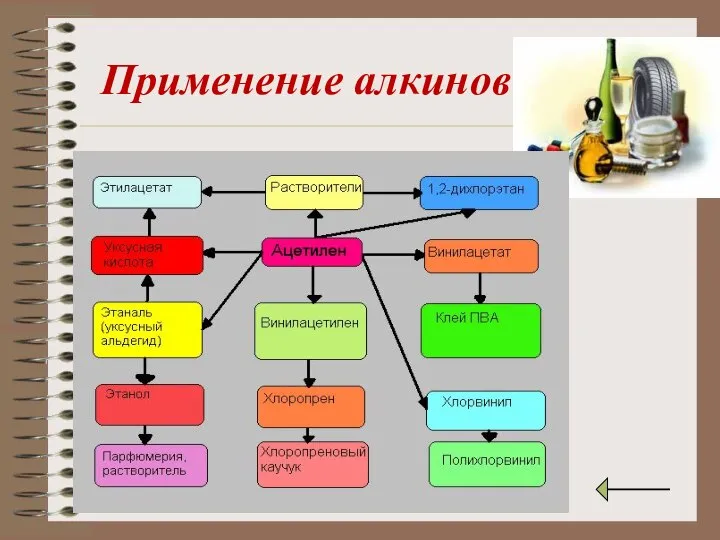
- 16. Применение алкинов
- 18. Скачать презентацию








![2. Гидрогалогенирование. 3. Гидрирование. 4. Гидратация. HgSO4 Н−C≡C−H + H2O ⎯→ [H−C=C−H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1072202/slide-10.jpg)




 Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів
Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Эмпирические правила
Эмпирические правила Получение галогеноалканов
Получение галогеноалканов Алканы 10-класс
Алканы 10-класс Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Понятие о спиртах
Понятие о спиртах Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Классификация неорганических соединений
Классификация неорганических соединений Химические уравнения
Химические уравнения Водород. Вода
Водород. Вода Атомы химических элементов
Атомы химических элементов Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Предмет органической химии
Предмет органической химии Презентация по Химии "Sulfur"
Презентация по Химии "Sulfur"  Классификация методов аналитической химии
Классификация методов аналитической химии Химическая связь
Химическая связь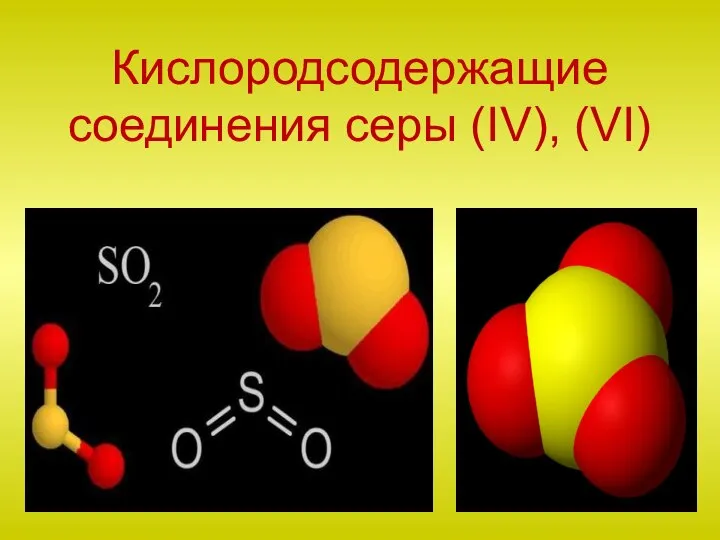 Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Алкены
Алкены Поликарбонат мономерлері
Поликарбонат мономерлері Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Железо и его соединения
Железо и его соединения Кислород и водород
Кислород и водород Электролитическая диссоциация
Электролитическая диссоциация Метод валентных связей
Метод валентных связей