Слайд 2Кристаллическая решетка
Металлическая - в ее узлах находятся положительно заряженные ионы, а

между ними свободно перемещаются электроны. Наличие последних объясняет высокую электропроводность и теплопроводность, а также способность поддаваться механической обработке.
Слайд 3Все металлы делятся на две большие группы:
Черные металлы : Имеют темно-серый цвет,

большую плотность, высокую температуру плавления и относительно высокую твердость. Типичным представителем черных металлов является железо.
Слайд 4Цветные металлы:
Имеют характерную окраску: красную, желтую, белую; обладают большой пластичностью, малой твердостью,

относительно низкой температурой плавления.
Типичным представителем цветных металлов является медь.
Слайд 5Агрегатное состояние
Все металлы твердые, исключение ртуть - единственный жидкий металл.

Слайд 6Типы кристаллических решёток
а) объемноцентрированная кубическая
Cr, V, a-Fe, Pb, W
б) гранецентрированная кубическая
Al,
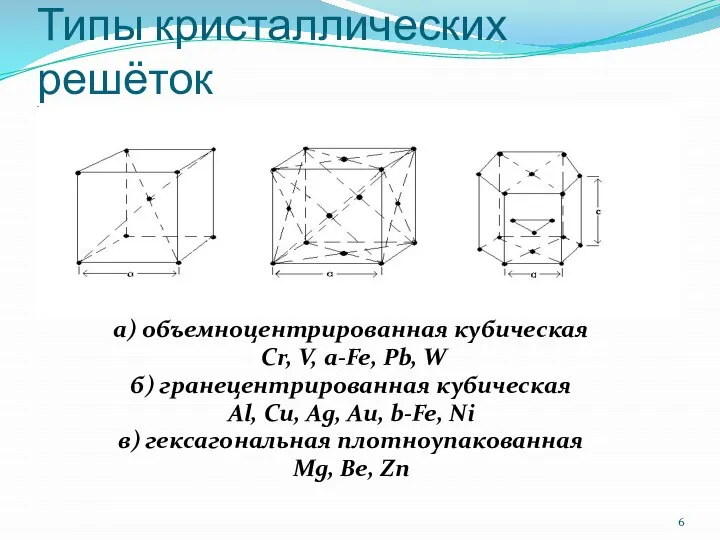
Cu, Ag, Au, b-Fe, Ni
в) гексагональная плотноупакованная
Mg, Be, Zn
Слайд 7Физические свойства металлов

Слайд 8Пластичность
Способность изменять свою форму при ударе, прокатываться в тонкие листы,

вытягиваться в проволоку: золото, серебро, медь, алюминий. Из 1г золота можно вытянуть проволоку длиной 2 км.
Слайд 9Металлический блеск
Световые лучи падают на поверхность металла и отталкиваются от неё

свободными электронами, создавая эффект металлического блеска.
Слайд 10Плотность
В зависимости от своей плотности металлы делятся на:
Легкие (плотность не более 5

г/см3 )К легким металлам относятся: литий , натрий , калий , магний , кальций , цезий , алюминий , барий.
Самый легкий металл — литий, плотность 0.534 г/см3.
Тяжелые (плотность больше 5 г/см3).К тяжелым металлам относятся: цинк , медь , железо , олово , свинец , серебро , золото , ртуть и др.
Самый тяжелый металл — осмий , плотность 22,5 г/см3.
Слайд 11По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко

отдают валентные электроны, переходят в положительно заряженные ионы, то есть окисляются. Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов, или ряду стандартных электродных потенциалов металлов.
Слайд 12К I группе относятся активные металлы.
Ко II группе – металлы средней активности.
К

III – пассивные металлы.
Типы металлов
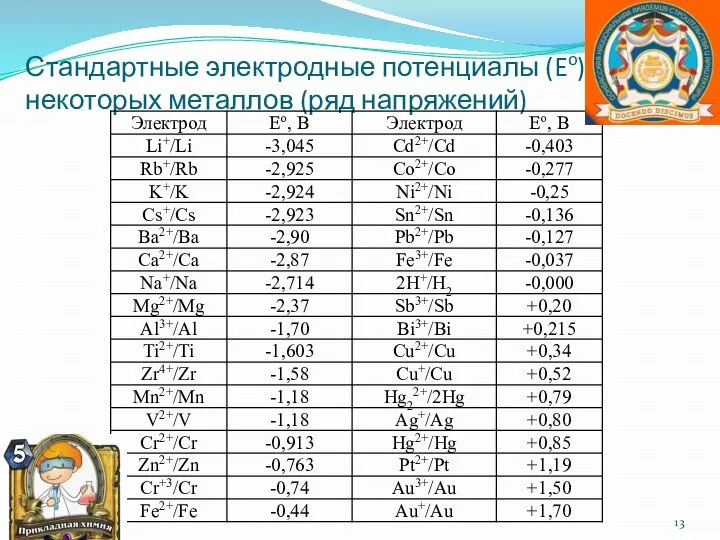
Слайд 13Стандартные электродные потенциалы (Eo), некоторых металлов (ряд напряжений)
Слайд 14Металлы реагируют с солями в водных растворах. Активные металлы вытесняют менее активные

металлы из состава солей. Определить это можно по ряду активности металлов. Продуктами реакции являются новая соль и новый металл. Так, если железную пластинку погрузить в раствор меди (II) сульфата, через некоторое время на ней выделится медь в виде красного налета:
Fe0 + Cu+2SO4 → Fe+2SO4 + Cu0 .
Но если в раствор меди (II) сульфата погрузить серебряную пластину, то никакой реакции не произойдет:
Ag + CuSO4 ≠ .
Для проведения таких реакции нельзя брать слишком активные металлы (от лития до натрия), которые способны реагировать с водой.
Слайд 17Взаимодействие с простыми веществами
С кислородом большинство металлов образует оксиды – амфотерные и

основные:
4Li + O2 = 2Li2O,
4Al + 3O2 = 2Al2O3.
Щелочные металлы, за исключением лития, образуют пероксиды:
2Na + O2 = Na2O2.
С галогенами металлы образуют соли галогеноводородных кислот, например,
Cu + Cl2 = CuCl2.
Слайд 18Взаимодействие с простыми веществами
3. С водородом самые активные металлы образуют ионные гидриды

– солеподобные вещества, в которых водород имеет степень окисления -1.
2Na + H2 = 2NaH.
4. С серой металлы образуют сульфиды – соли сероводородной кислоты:
Zn + S = ZnS.
5. С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании:
3Mg + N2 = Mg3N2.
6. С углеродом образуются карбиды:
4Al + 3C = Al3C4.
Слайд 197. С фосфором – фосфиды:
3Ca + 2P = Ca3P2.
8. Металлы могут

взаимодействовать между собой, образуя интерметаллические соединения:
2Na + Sb = Na2Sb,
3Cu + Au = Cu3Au.
9. Металлы могут растворяться друг в друге при высокой температуре без взаимодействия, образуя сплавы.

















 Презентация на тему Обобщение: предельные и непредельные углеводороды
Презентация на тему Обобщение: предельные и непредельные углеводороды  Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала
Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала 7 Классиф неорг веществ презентация 2 (1)
7 Классиф неорг веществ презентация 2 (1) Валентность, Составление формул
Валентность, Составление формул Курс Технология конструкционных материалов
Курс Технология конструкционных материалов Свойства кислот, оснований и солей как электролитов
Свойства кислот, оснований и солей как электролитов химия
химия Химия элементов VIA группы
Химия элементов VIA группы Определение содержания витамина С в домашних условиях
Определение содержания витамина С в домашних условиях Гетероциклические соединения
Гетероциклические соединения Презентация на тему Кислород
Презентация на тему Кислород  Углеводороды
Углеводороды Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка
Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю 9. Потомки светоносного элемента
9. Потомки светоносного элемента Premeny látok. Horenie ako chemická reakcia
Premeny látok. Horenie ako chemická reakcia Презентация на тему Подгруппа кислорода
Презентация на тему Подгруппа кислорода  Классификация органических соединений
Классификация органических соединений Полиморфизм. Аллотропия
Полиморфизм. Аллотропия Борьба с загрязнением пластиковыми материалами
Борьба с загрязнением пластиковыми материалами Малотоннажные термопласты
Малотоннажные термопласты Коррозия металлов
Коррозия металлов Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Как вырастить кристалл
Как вырастить кристалл Бромистый этил
Бромистый этил Минералы
Минералы Органическая химия. Получение альдегидов и кетонов
Органическая химия. Получение альдегидов и кетонов Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений