Содержание
- 2. Фосфор был открыт немецким алхимиком X. Брэндом в 1669 г. Позже А. Лавуазье доказал, что фосфор
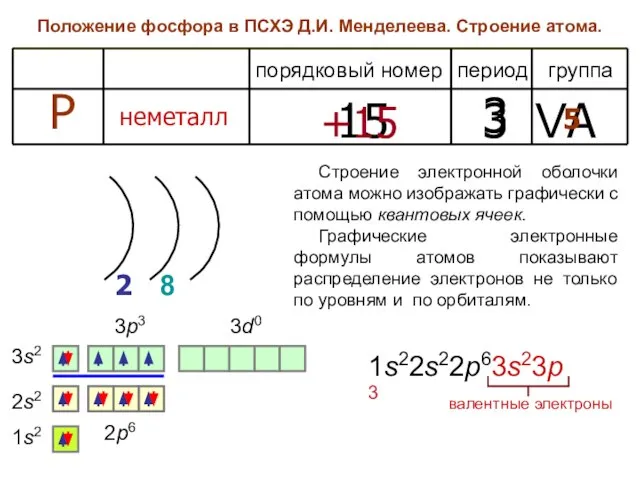
- 3. Положение фосфора в ПСХЭ Д.И. Менделеева. Строение атома. период группа порядковый номер Р неметалл 15 3
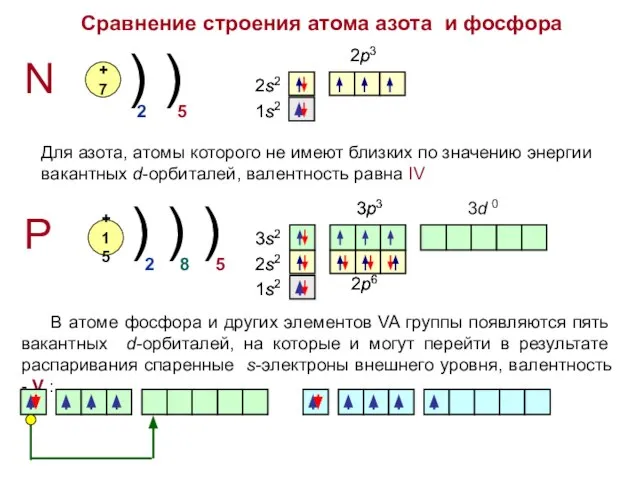
- 4. Сравнение строения атома азота и фосфора N P +7 +15 ) ) ) ) ) 2
- 5. Нахождение в природе Содержание фосфора в земной коре составляет 0,093%. В природе фосфор встречается только в
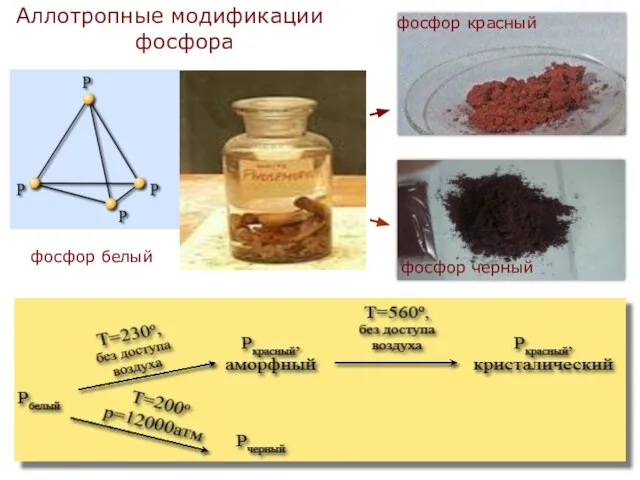
- 6. Аллотропные модификации фосфора фосфор белый фосфор черный фосфор красный
- 7. Белый фосфор - твердое кристаллическое вещество, плотность его 1,82 г/см3. На воздухе самовоспламеняется, в темноте светится.
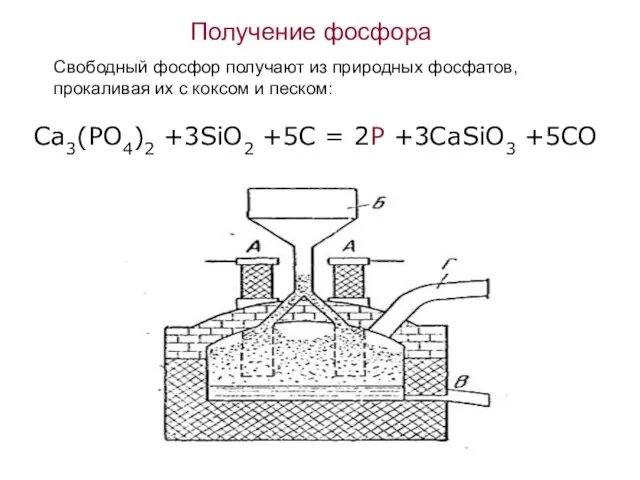
- 8. Получение фосфора Свободный фосфор получают из природных фосфатов, прокаливая их с коксом и песком: Ca3(PO4)2 +3SiO2
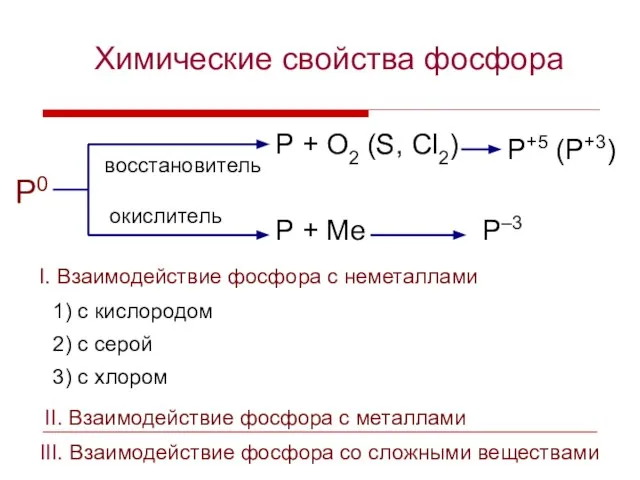
- 9. Химические свойства фосфора P0 P + O2 (S, Cl2) P+5 (P+3) восстановитель окислитель P + Ме
- 10. I. Взаимодействие фосфора с неметаллами Составьте уравнения реакций взаимодействия фосфора с кислородом, серой, хлором. Назовите окислитель
- 11. Так же, как с кислородом, фосфор реагирует и с другим халькогеном – серой: P0 + S0
- 12. P0 + Cl20 = P+3Cl3–1 P0 + Cl20 = P+5Cl5–1 P0 –3e → P+3 3 2
- 13. III. Взаимодействие фосфора с металлами Взаимодействие фосфора с кальцием Составьте уравнение реакции взаимодействия фосфора с кальцием,
- 14. Фосфиды энергично разлагаются водой с выделением фосфина. Фосфин очень ядовитый газ с чесночным запахом. Ca3P2 +
- 15. III. Взаимодействие фосфора со сложными веществами: С концентрированными кислотами (азотной и серной); 2. Раствором щелочи; 3.
- 17. Скачать презентацию









 Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс
Кислотность почв с.Берёзовка МОУ «СОШ с.Берёзовка» Колесников Иван, 9 класс Пряхина Виктория, 8 класс Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6
Химические методы анализа. Аналитические методы контроля в техносферной безопасности. Лекция 6 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Химическая реакция в потоке в одномерном случае. Уравнение неразрывности
Химическая реакция в потоке в одномерном случае. Уравнение неразрывности Химические свойства оксидов
Химические свойства оксидов Побочная подгруппа VII группы периодической системы
Побочная подгруппа VII группы периодической системы Многообразие органических веществ
Многообразие органических веществ Обозначения групп симметрии по Шенфлису
Обозначения групп симметрии по Шенфлису Клеящие материалы
Клеящие материалы Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Материаловедение. Адсорбционные материалы. Металлоорганические каркасы
Материаловедение. Адсорбционные материалы. Металлоорганические каркасы Классификация белков
Классификация белков Химическая термодинамика
Химическая термодинамика Классификация веществ
Классификация веществ Кислород
Кислород Распределение электронов в атомах
Распределение электронов в атомах Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) Презентация на тему Войди в природу другом
Презентация на тему Войди в природу другом  Якісні реакції органічних речовин
Якісні реакції органічних речовин Презентация на тему Химические синонимы
Презентация на тему Химические синонимы  Основные законы химии
Основные законы химии Магний
Магний Коррозия металлов
Коррозия металлов Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ ГАЛОГЕНЫ
ГАЛОГЕНЫ Алкины: получение и свойства
Алкины: получение и свойства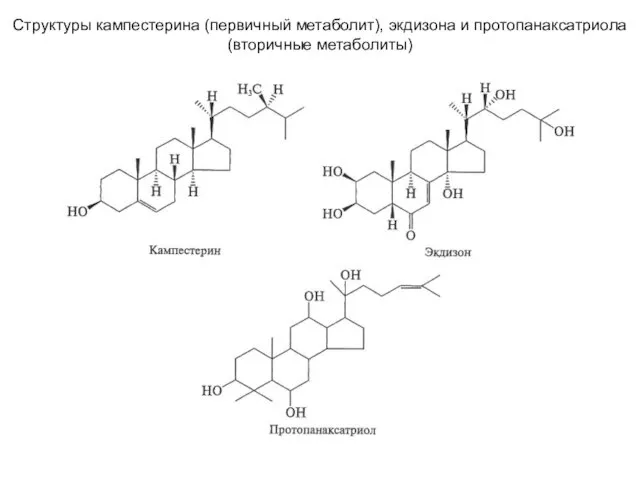 Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова