Содержание
- 2. Галогены- (в переводе с греческого – «рождающие соли» ) - элементы главной подгруппы VII группы Периодической
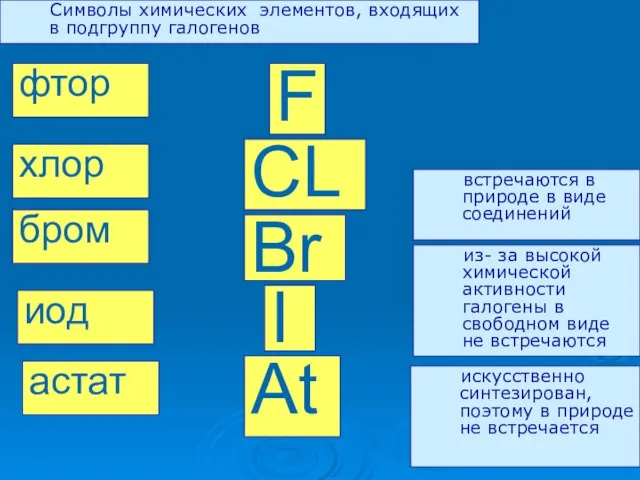
- 3. F CL Br I At фтор хлор бром иод астат Символы химических элементов, входящих в подгруппу
- 4. F CL +9 +17 2 е - 2 е - 7 е 8 е 7 е
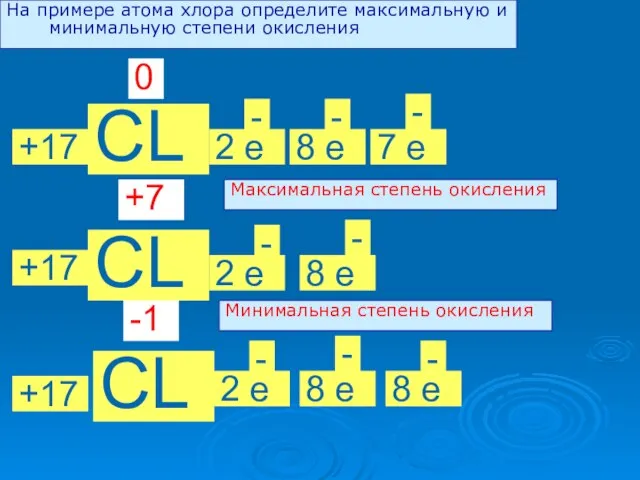
- 5. На примере атома хлора определите максимальную и минимальную степени окисления +17 CL 2 е - 8
- 6. F CL Br I Сходства: 7 валентных электронов на внешнем уровне Максимальная степень окисления +7, минимальная
- 7. Общая формула высшего оксида: Г2O7 Г- галоген Общая формула летучего водородного соединения: HГ Общая формула высшего
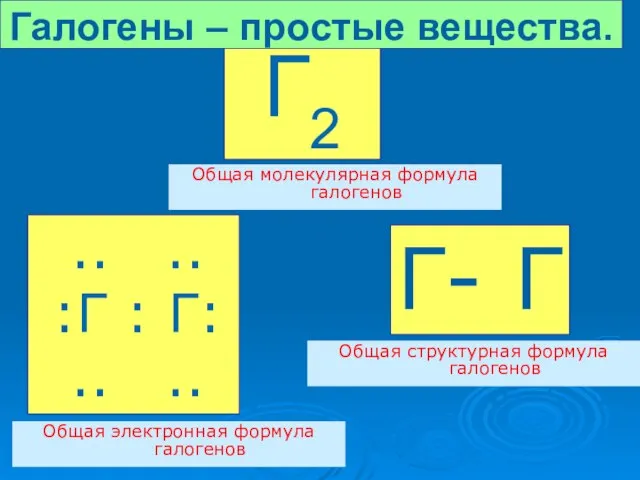
- 8. .. .. :Г : Г: .. .. Г2 Общая молекулярная формула галогенов Г- Г Общая структурная
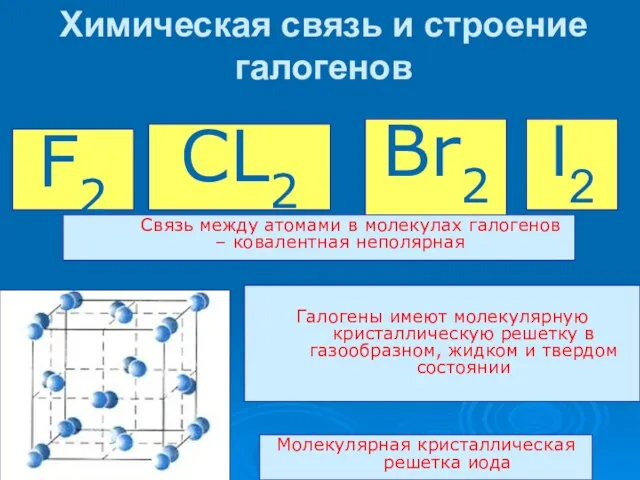
- 9. Химическая связь и строение галогенов Молекулярная кристаллическая решетка иода F2 CL2 Br2 I2 Связь между атомами
- 10. С увеличением атомной массы галогенов окраска становится более темной, возрастают температуры плавления и кипения, а также
- 11. Все галогены обладают очень резким запахом. Вдыхание их даже в небольших количествах вызывает сильное раздражение дыхательных
- 12. Лабораторный опыт № 3. Растворимость брома и иода в органических растворителях В выводе: Объясните наблюдаемые изменения
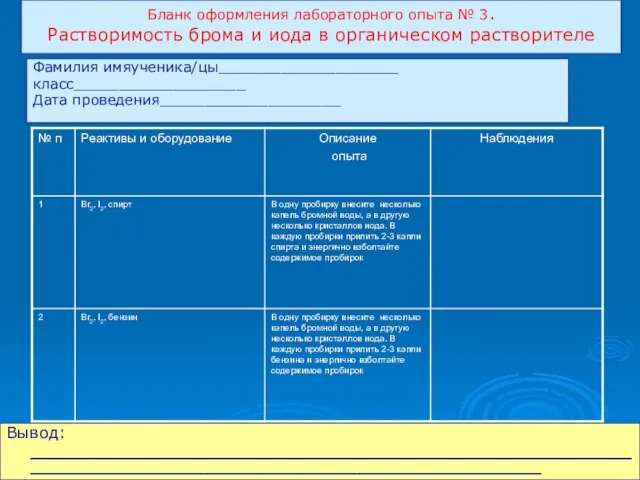
- 13. Бланк оформления лабораторного опыта № 3. Растворимость брома и иода в органическом растворителе Вывод: __________________________________________________________________________________________________ Фамилия
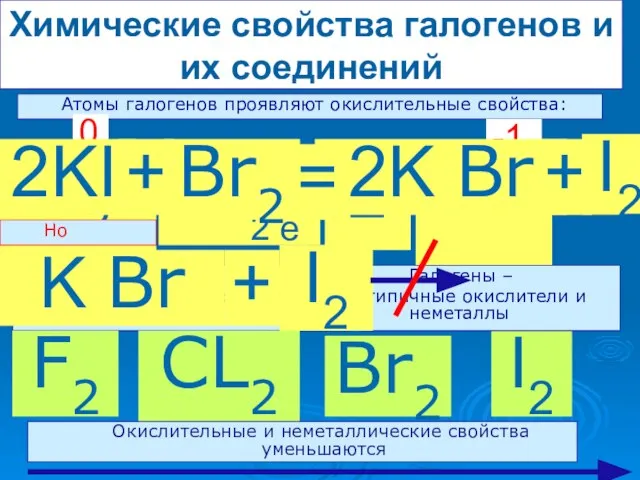
- 14. Химические свойства галогенов и их соединений Атомы галогенов проявляют окислительные свойства: Г2 + 2 е -
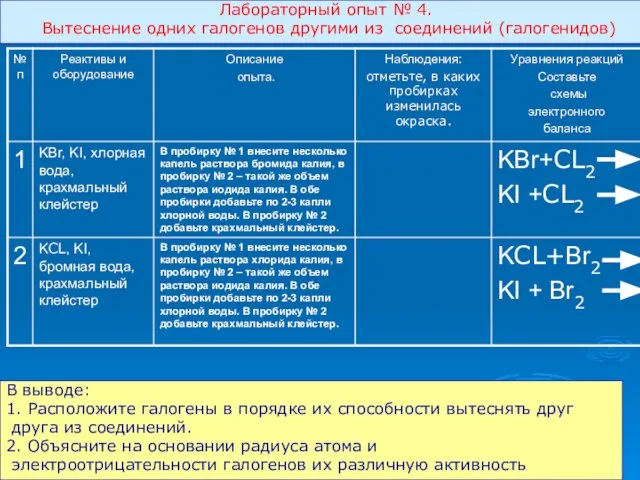
- 15. Лабораторный опыт № 4. Вытеснение одних галогенов другими из соединений (галогенидов) В выводе: 1. Расположите галогены
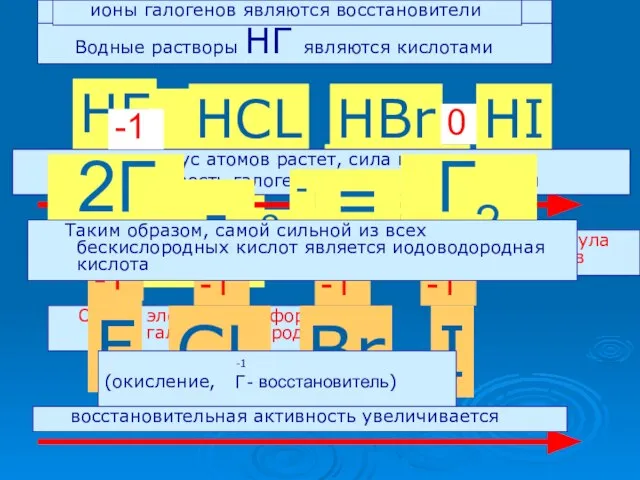
- 16. .. Н :Г: .. С водородом галогены образуют летучие водородные соединения НГ Общая электронная формула галогеноводородов
- 18. Скачать презентацию







 Химическая связь. Метод валентных связей
Химическая связь. Метод валентных связей Инертные газы и перспективы их применения
Инертные газы и перспективы их применения Презентация на тему Неорганическая химия: подготовка к ГИА
Презентация на тему Неорганическая химия: подготовка к ГИА  Применение центрифугирования
Применение центрифугирования Презентация на тему Разделение смесей, основанное на явлении сорбции
Презентация на тему Разделение смесей, основанное на явлении сорбции  Ароматические углеводороды
Ароматические углеводороды Основные формулы МКТ
Основные формулы МКТ Оксиды в мире минералов
Оксиды в мире минералов Сахар-рафинад
Сахар-рафинад Агрегатные состояния воды
Агрегатные состояния воды Клеящие материалы
Клеящие материалы Химия в быту
Химия в быту Характеристика кислорода как химического элемента и простого вещества
Характеристика кислорода как химического элемента и простого вещества Серная кислота и ее соли
Серная кислота и ее соли Актуальные задачи химии
Актуальные задачи химии Презентация на тему Спирты 10 класс
Презентация на тему Спирты 10 класс  Презентация на тему Типы химических реакций
Презентация на тему Типы химических реакций  Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка
Резина на основе нитрильных каучуков с повышенными эксплуатационными свойствами. Разработка Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю Презентация на тему Наука о стекле в творчестве М.В. Ломоносова и в наши дни
Презентация на тему Наука о стекле в творчестве М.В. Ломоносова и в наши дни  Химия нефти и газа
Химия нефти и газа Интеллектуальная игра по химии «Металлы»
Интеллектуальная игра по химии «Металлы» Свойства белков
Свойства белков Химическое равновесие
Химическое равновесие Алкины. Строение.номенклатура. Изомерия. Получение
Алкины. Строение.номенклатура. Изомерия. Получение Известняк. Разновидности известняка. Области применения
Известняк. Разновидности известняка. Области применения Алкины
Алкины Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея
Значение периодического закона для современной науки и техники (связь химии с экономикой и экологией) Учитель химии МОУ лицея