Содержание
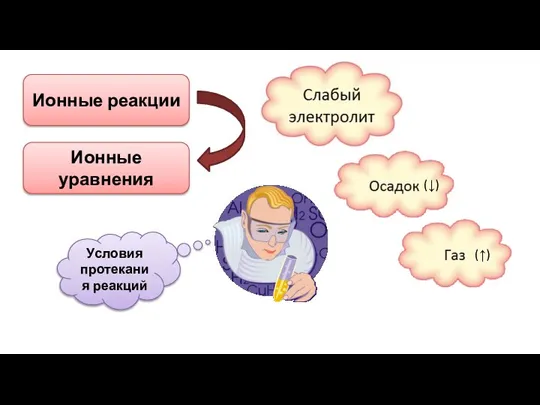
- 2. Ионные реакции Ионные уравнения (↓) (↑) Условия протекания реакций
- 3. Образование осадка NaCl + AgNO3 = NaNO3 + AgCl↓ Na+ + Cl- + Ag+ + NO3-
- 4. Образование малодиссоциирующего вещества
- 5. 2KOH + H2SO4 = K2SO4 + 2H2O Молекулярное уравнение 2K+ + 2OH- + 2H+ + SO42-
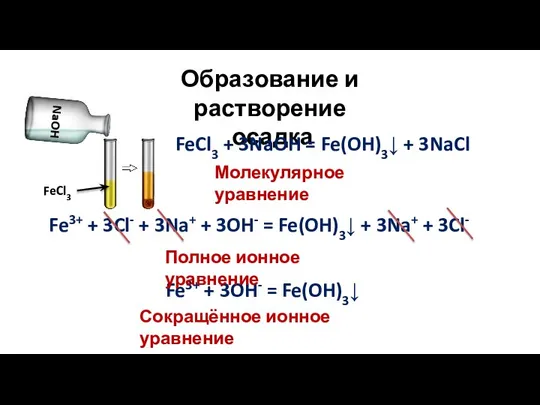
- 6. Образование и растворение осадка FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl Fe3+ + 3Cl- + 3Na+
- 7. Fe(OH)3 + 3H+ = Fe3+ + 3H2O
- 9. Скачать презентацию




 Обобщение знаний об основных классах неорганических соединений
Обобщение знаний об основных классах неорганических соединений X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии
X-Ray Diffraction in Biology (XRD). Физический принцип кристаллографии Натуральный каучук
Натуральный каучук Алкены
Алкены Ароматические углеводороды
Ароматические углеводороды Презентация на тему Хлор
Презентация на тему Хлор  Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Любовь и химия
Любовь и химия Презентация на тему Занимательная химия
Презентация на тему Занимательная химия  Ароматические вещества и их значение для человека
Ароматические вещества и их значение для человека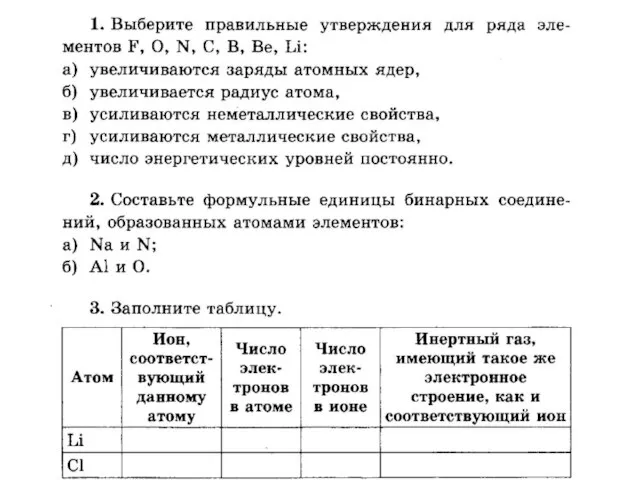 Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой Водород. Вода
Водород. Вода Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Общие химические свойства металлов
Общие химические свойства металлов Металлургия
Металлургия Амины и анилин
Амины и анилин Сущность химических реакций и признаки их протекания
Сущность химических реакций и признаки их протекания Свойства химической связи
Свойства химической связи Углеводы. Глюкоза. 10 класс
Углеводы. Глюкоза. 10 класс Применение углерода
Применение углерода علاوي الندوة
علاوي الندوة Альдегиды
Альдегиды Кислоты. Кислоты, вокруг нас
Кислоты. Кислоты, вокруг нас Изменения, происходящие с веществами. Физические явления в химии
Изменения, происходящие с веществами. Физические явления в химии Натуральные и синтетические каучуки
Натуральные и синтетические каучуки Физико-химия поверхностных явлений в функционировании живых систем
Физико-химия поверхностных явлений в функционировании живых систем Презентация на тему Химические волокна
Презентация на тему Химические волокна  Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра