Содержание
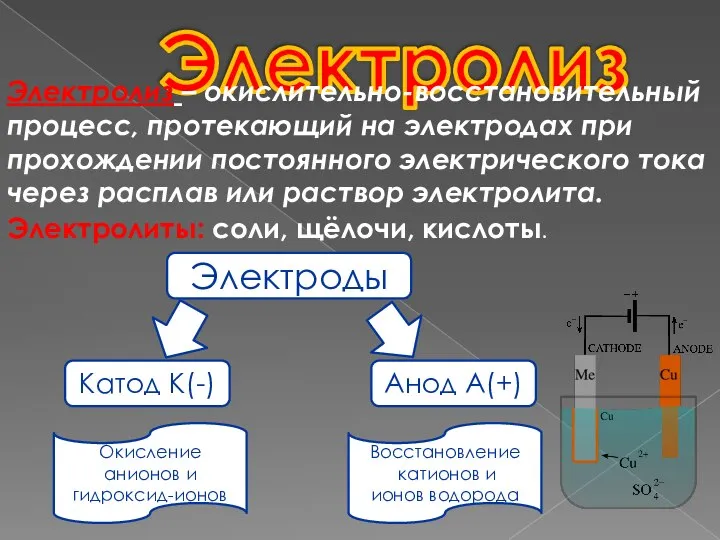
- 2. Электролиз Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или
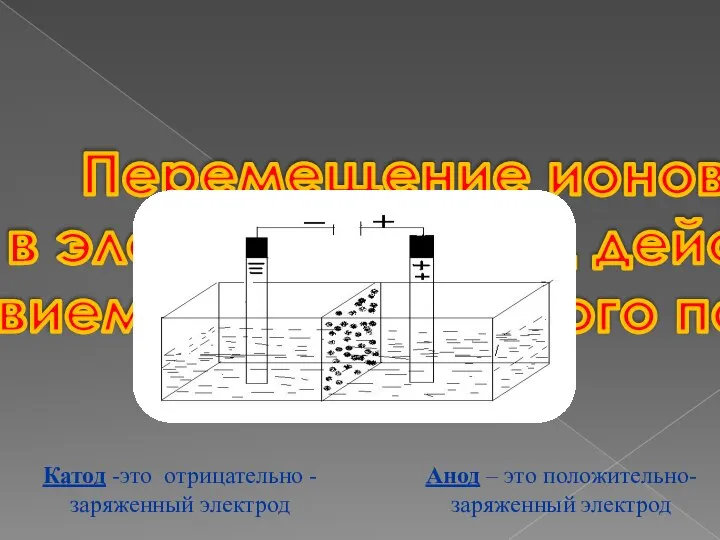
- 3. Перемещение ионов в электролите под дейст- вием электрического поля Анод – это положительно- заряженный электрод Катод
- 4. Процесс на катоде Если в растворе ионы Н+ - они разряжаются до Н2 Металлы правее Н:
- 5. Процесс на аноде если анод растворяется (железо, цинк, медь, серебро и все металлы, которые окисляются в
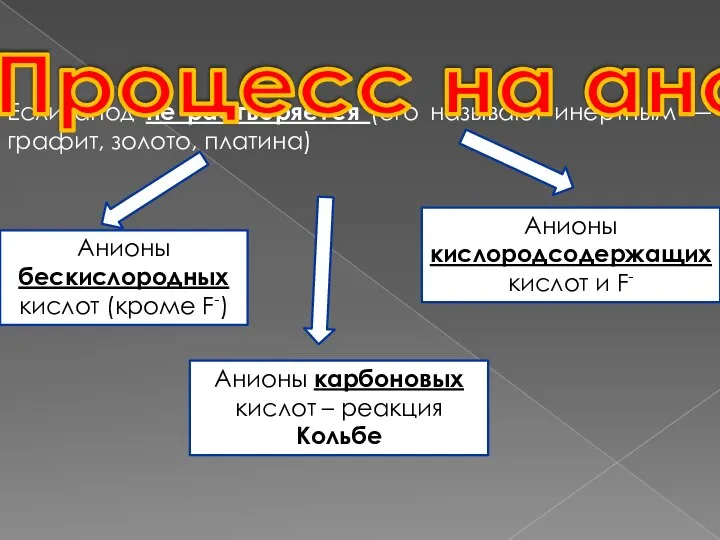
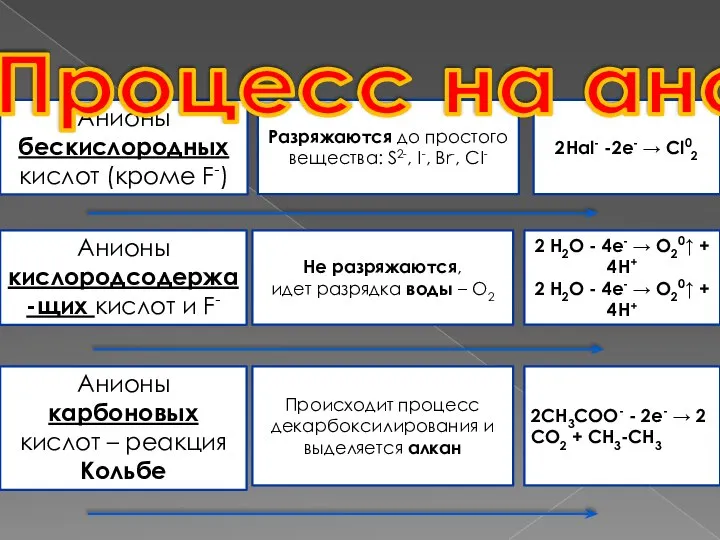
- 6. Если анод не растворяется (его называют инертным — графит, золото, платина) Процесс на аноде Анионы бескислородных
- 7. Анионы бескислородных кислот (кроме F-) Разряжаются до простого вещества: S2-, I-, Br-, СI- 2Hal- -2e- →
- 8. Закон электролиза Законы Фарадея. Масса веществ, выделившегося на электроде при электролизе, пропорциональна количеству электричества, прошедшее через
- 9. Применение электролиза Для получения щёлочных, щёлочноземельных металлов, алюминия, лантаноидов Для получения точных металлических копий, что называется
- 11. Скачать презентацию




 Органическая химия. Получение альдегидов и кетонов
Органическая химия. Получение альдегидов и кетонов Нафта. Походження, переробка, використання
Нафта. Походження, переробка, використання Удельная теплота сгорания
Удельная теплота сгорания Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Строение электронных оболочек атома
Строение электронных оболочек атома Водород. Доклад по химии
Водород. Доклад по химии Термохимия
Термохимия Анализ образца доломита методами аналитической химии
Анализ образца доломита методами аналитической химии Вода. Физические и химические свойства
Вода. Физические и химические свойства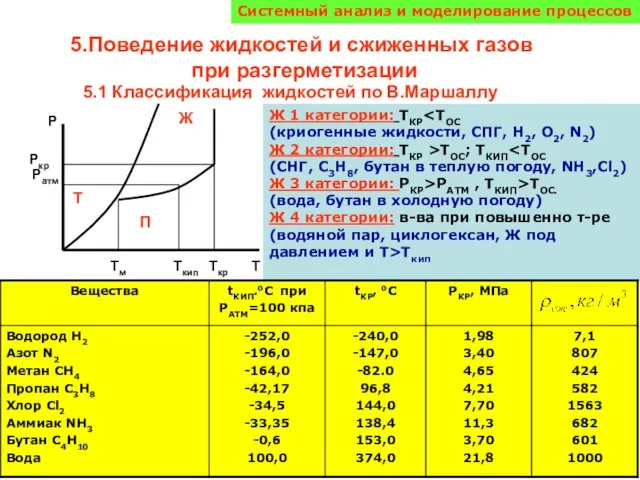 Поведение жидкостей и сжиженных газов при разгерметизации
Поведение жидкостей и сжиженных газов при разгерметизации Компетентностный подход в обучении химии "Плохой учитель преподносит истину, хороший учит ее находить» А. Дист
Компетентностный подход в обучении химии "Плохой учитель преподносит истину, хороший учит ее находить» А. Дист Серебро
Серебро Железо
Железо Строение атома
Строение атома Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Биогаз. Технология производства
Биогаз. Технология производства Роль химии в Великой Отечественной войне
Роль химии в Великой Отечественной войне Относительная атомная и молекулярная масса
Относительная атомная и молекулярная масса Презентация на тему Натуральные волокна
Презентация на тему Натуральные волокна  Значимые личности в химии
Значимые личности в химии Описание молекул
Описание молекул Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Презентация на тему Изомерия
Презентация на тему Изомерия  Природный газ
Природный газ Физические явления. Способы разделения смесей
Физические явления. Способы разделения смесей Непредельные углеводороды: алкены и алкины
Непредельные углеводороды: алкены и алкины Спирты
Спирты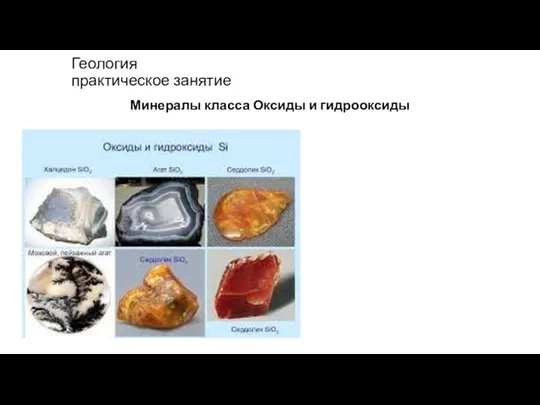 Оксиды и гидрооксиды
Оксиды и гидрооксиды