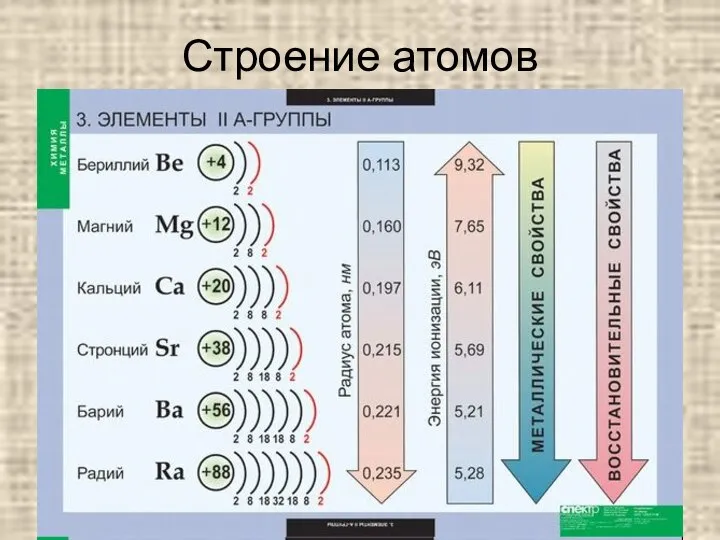
Слайд 2Строение атомов
Общая электронная формула ns2
Валентность II
Степень окисления +2
Восстановительные свойства
Менее реакционно-способны, чем щелочные

металлы
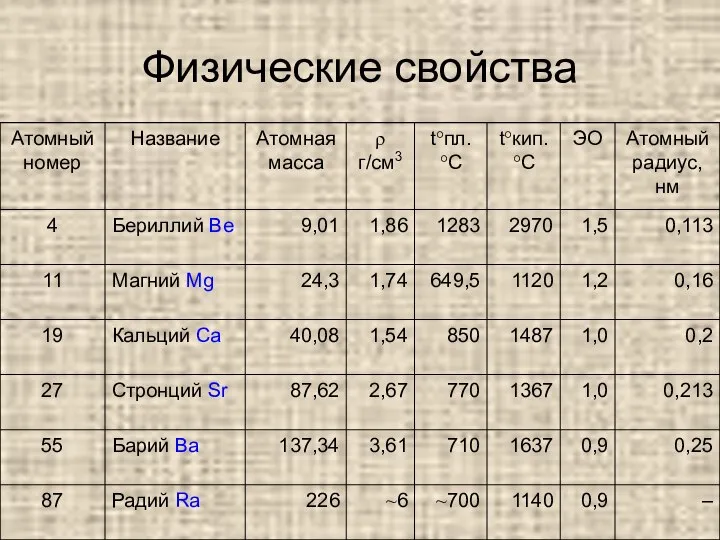
Слайд 5Физические свойства
серебристо-белые блестящие металлы, твердость значительно выше, чем у щелочных металлов.

Слайд 6Be
3BeO • Al2O3 • 6SiO2 –
берилл

Слайд 7Mg
MgCO3 – магнезит
CaCO3 • MgCO3 – доломит
KCl • MgSO4 • 3H2O –

каинит
KCl • MgCl2 • 6H2O – карналлит
Слайд 8Ca
CaCO3 – кальцит
(известняк, мрамор и др.)
Ca3(PO4)2 – апатит, фосфорит
CaSO4 • 2H2O

– гипс
CaSO4 – ангидрит
CaF2 – плавиковый шпат
(флюорит)
Слайд 9
SrSO4 – целестин
SrCO3 – стронцианит
BaSO4 – барит
BaCO3 – витерит
во всём мире удалось
добыть

всего 1,5 кг
чистого радия
Sr, Ba и Ra
Слайд 10Химические свойства
1. Все металлы образуют оксиды RO, барий-пероксид – BaO2
2Me

+O2 → 2MeO
2. Бериллий и магний сравнительно медленно реагируют с неметаллами
Me +H2 → MeH2
Me +Cl2 → MeCl2
Me +S → MeS
Слайд 11Химические свойства
3. Растворяются в кислотах:
Me +2HCl → MeCl2 + H2

Бериллий растворяется в водных растворах щелочей
4. В обычных условиях поверхность Be и Mg покрыта инертной оксидной пленкой, поэтому они устойчивы по отношению к воде.
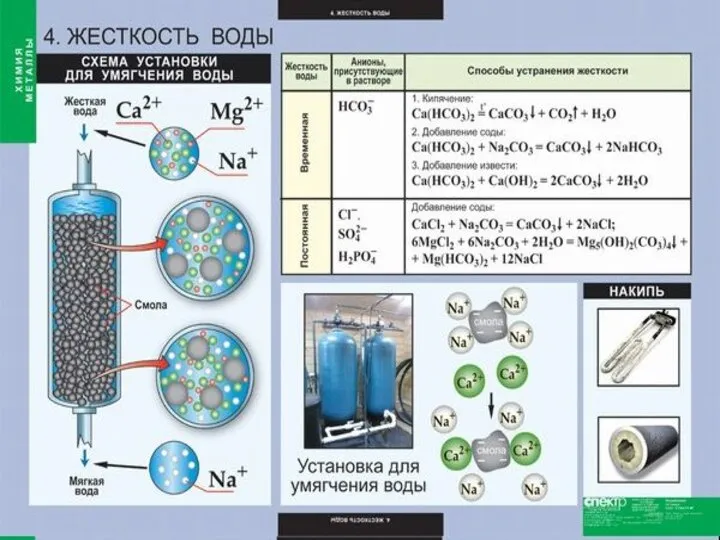
Ca, Sr и Ba растворяются в воде с образованием гидроксидов Me +2HOH → Me(OH)2 +Н2
Слайд 12Качественная реакция на катионы щелочноземельных металлов – окрашивание пламени в следующие цвета:
Ca2+

- темно-оранжевый
Sr2+- темно-красный
Ba2+ - светло-зеленый
Слайд 14Проверка знаний
Сравните атомы элементов, поставив знаки <, > или = вместо

*:
а) заряд ядра: Mg * Ca, Na *Mg, Ca * К;
б) число электронных слоев: Mg * Ca, Na * Mg,
Ca * К;
в) число электронов на внешнем уровне: Mg * Ca, Na *Mg, Ca * К;
г) радиус атома: Mg * Ca, Na * Mg, Ca * K;
д) восстановительные свойства: Mg * Ca,
Na * Mg, Ca * K.
Слайд 15Допишите уравнения реакций:
а) Са + H2O→ ……………………….
б) Mg + НСl→……………………….

в) Ва + О2→………………………..
Осуществить превращения по схеме:
Ме → МеО → Ме(ОН)2 → МеSО4











 Комплексные соединения
Комплексные соединения Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов
Алкены. Гомологический ряд алкенов. Изомерия алкенов. Химические свойства алкенов Система маркировки пластика
Система маркировки пластика Nanofibers of aluminum oxide
Nanofibers of aluminum oxide Щелочные металлы
Щелочные металлы Механизмы и методы формирования кристаллов
Механизмы и методы формирования кристаллов Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова Электролиз
Электролиз Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Металлы в организме человека
Металлы в организме человека Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Электролитическая диссоциация
Электролитическая диссоциация Основы химии буровых растворов
Основы химии буровых растворов Жидкокристаллический эластомер как роторный актуатор
Жидкокристаллический эластомер как роторный актуатор Презентация на тему Типы химических реакций на примере свойств воды
Презентация на тему Типы химических реакций на примере свойств воды  Причины многообразия веществ. 11 класс
Причины многообразия веществ. 11 класс Алкены
Алкены Азот
Азот Химическая викторина
Химическая викторина Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Алкадиены, каучуки
Алкадиены, каучуки Синтез олигомеров этиленгликоля и терефталевой кислоты
Синтез олигомеров этиленгликоля и терефталевой кислоты Влияние на скорость ферментативной реакции
Влияние на скорость ферментативной реакции Предмет органической химии
Предмет органической химии Тепловой эффект
Тепловой эффект Презентация на тему Барометр анероид
Презентация на тему Барометр анероид  Химические свойства и получение спиртов
Химические свойства и получение спиртов Физико-химические методы анализа. Лекция 4
Физико-химические методы анализа. Лекция 4