Слайд 2Al
13
Алюминий
(лат. (лат. Aluminium(лат. Aluminium)
3
8
2
26,9815
3s2 3p1
Порядковый номер. Химический элемент III группы

главной подгруппы 3-го периода.
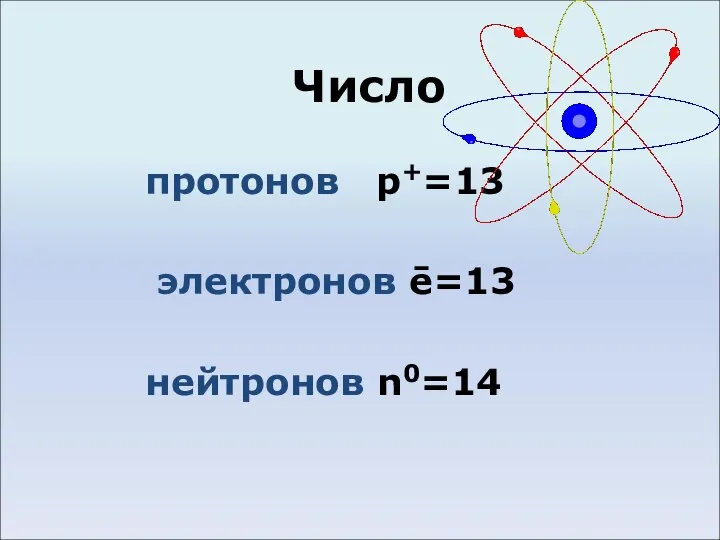
Слайд 3Число
протонов p+=13
электронов ē=13
нейтронов n0=14
Слайд 4Схема расположения электронов на энергетических подуровнях
+13Al 1s2 2s2 2p6 3s2 3p1
1s
2s
2p
3s
3p
в
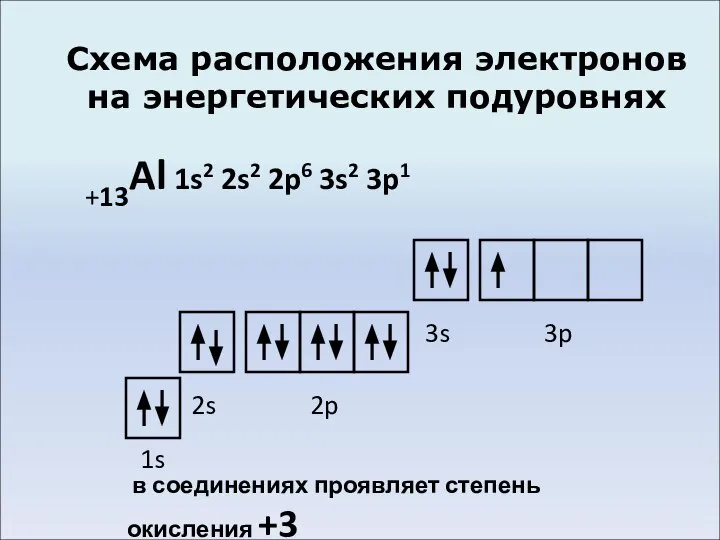
соединениях проявляет степень окисления +3
Слайд 5Al – типичный металл
Восстановительные свойства
Al 0- 3ē Al+3
Тип химической связи -металлическая
Тип

кристаллической решетки – кубическая гранецентрированная
Слайд 6Физические свойства вещества
Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и

электрический ток, обладает хорошей ковкостью, легко поддаётся обработке, образует лёгкие и прочные сплавы.
ρ=2,7 г/см3
tпл.=6600С
Слайд 7Алюминий реагирует с простыми веществами - неметаллами
4Al+3O2 = 2Al2O3
Поверхность покрывается

пленкой оксида, в мелкораздробленном виде горит с выделением большого количества теплоты.
2. 2Al + 3Cl2 = 2 AlCl3
3. 2Al + 3S = Al2S3 - при нагревании
4. 4Al + 3С = Al4С3 - при нагревании
Слайд 8Алюминий реагирует со сложными веществами:
Алюминий растворяется в растворах кислот
2Al + 6HCl =

2AlCl3 + 3H2
2Al + 3H2SO4 = Al2(SO4)3 + 3H2
Концентрированная серная и азотная кислоты пассивируют алюминий.
2. Алюминий реагирует с растворами солей менее активных металлов
2Al + 3СuCl2 = 2AlCl3 + 3Cu
Слайд 9Алюминий реагирует со сложными веществами:
3. Алюминий при высокой температуре реагирует с оксидами

менее активных металлов (Алюминотермия – получение металлов: Fe, Cr, Mn, Ti, W и других, путем их восстановления алюминием)
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 10Алюминий реагирует со сложными веществами:
4.Так как алюминий – амфотерный металл, он реагирует

с растворами щелочей.
При этом образуется тетрагидроксоалюминат натрия и выделяется водород:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
5. При удалении оксидной пленки с поверхности алюминия, он реагирует с водой с образованием гидроксида алюминия и водорода:
2Al + 6H2O = 2Al(OH)3 +3H2
Слайд 11Получение алюминия
Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и
электролизом расплава

AlCl3
Слайд 13
Соединения алюминия
В природе алюминий встречается только в виде соединений и по

распространенности в земной коре занимает первое место среди металлов и третье – среди всех элементов (после кислорода и кремния). Общее содержание алюминия в земной коре составляет 8,8 % по массе.
Слайд 14Оксид алюминия Al2О3:
Очень твердый (корунд, рубин)в кристаллическом состоянии, порошок белого цвета, тугоплавкий

- 20500С.
Не растворяется в воде.
Амфотерный оксид, взаимодействует:
а) с кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O
б) со щелочами Al2O3 + 2OH- = 2AlO-2 + H2O
Образуется:
а) при окислении или горении алюминия на воздухе
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термическом разложении гидроксида алюминия 2Al (OH)3 = Al2O3 + 3H2O












 Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Без золота прожить можно, без соли нельзя
Без золота прожить можно, без соли нельзя Теория электролитической диссоциации
Теория электролитической диссоциации Тестирование по химии
Тестирование по химии Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения lektsia_7
lektsia_7 Основы химии буровых растворов
Основы химии буровых растворов Трансляция. Активирование аминокислоты
Трансляция. Активирование аминокислоты Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода Скорость химических реакций
Скорость химических реакций Презентация на тему Зеленая химия и проблемы устойчивого развития
Презентация на тему Зеленая химия и проблемы устойчивого развития  Строение бензола
Строение бензола Расчетная работа. Тепловой эффект клинкерообразования
Расчетная работа. Тепловой эффект клинкерообразования Электрохимия. Решение задач. ИДЗ 4
Электрохимия. Решение задач. ИДЗ 4 Электролиз. Правила электролиза
Электролиз. Правила электролиза Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Посвящение в химики
Посвящение в химики Кроссворд Интересные факты в химии
Кроссворд Интересные факты в химии Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Химическая связь. 11 класс
Химическая связь. 11 класс НХ 6 Растворы Коллигативные свойства
НХ 6 Растворы Коллигативные свойства Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1
Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1 Полимеры
Полимеры Төртінші негізгі топша элементтері
Төртінші негізгі топша элементтері Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10
Температурная зависимость времени спин-решеточной релаксации протонов в H2La2Ti3O10 Взаимодействие кислот с металлами
Взаимодействие кислот с металлами Ковалентная связь. Радикалы
Ковалентная связь. Радикалы