Содержание
- 2. С какими из перечисленных веществ будет реагировать гидроксид натрия, а с какими соляная кислота? Вещества: HNO3,
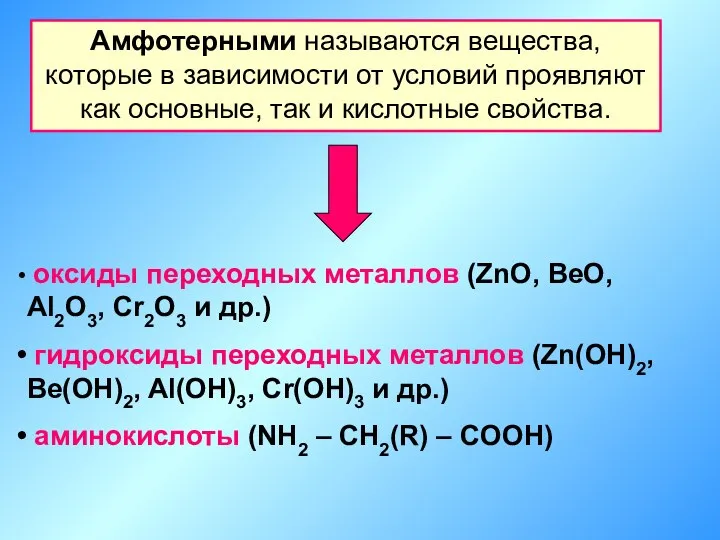
- 3. Амфотерными называются вещества, которые в зависимости от условий проявляют как основные, так и кислотные свойства. оксиды
- 4. Какие элементы образуют эти соединения? Металлы в степени окисления +3 и +4,а также металлы, металлические свойства
- 5. Физические свойства амфотерных гидроксидов Амфотерные гидроксиды – это нерастворимые в воде твердые вещества, как правило, белого
- 6. Реакцией обмена между растворимой солью соответствующего металла и щелочью ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl
- 7. Задание: получить гидроксид алюминия и определить его химические свойства есть растворы: хлорида алюминия, аммиака, соляной кислоты
- 8. AlCl3 + 3NH3 * H2O = Al(OH)3 + 3NH4Cl Вывод: гидроксид алюминия взаимодействует и с кислотами,
- 9. Как основание AlCl3 +3NH3* H2O=Al(OH)3+ 3NH4Cl Al(OH)3+3HCl=AlCl3+3H2O Al(OH)3 +3H+=Al3++3H2O Образуются соли катионного типа
- 10. Как кислота Al(OH)3+NaOH = Na[Al(OH)4] тетрагидроксоалюминат натрия Al(OH)3+OH- = [Al (OH)4] – Образуются соли анионного типа
- 11. Соли анионного типа устойчивы в щелочной среде, но разрушаются при подкислении растворов Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O
- 12. Амфотерные гидроксиды, как и нерастворимые основания, при нагревании разлагаются: 2Al(OH )3 Al2O3 + 3H2O
- 13. Экспериментальная задача Даны три пробирки с растворами хлоридов натрия, магния и алюминия. Как определить, в какой
- 14. 1. NaCl2 + NaOH =/= реакция не идет 2. MgCl2 + 2NaOH = Mg (OH)2 +
- 15. Осуществить превращения Вариант 1 Al-1- Al2O3 -2-- NaAlO2 -3-- Al (OH)3 -4-Al2O3 Вариант 2 AlCl3 -1-
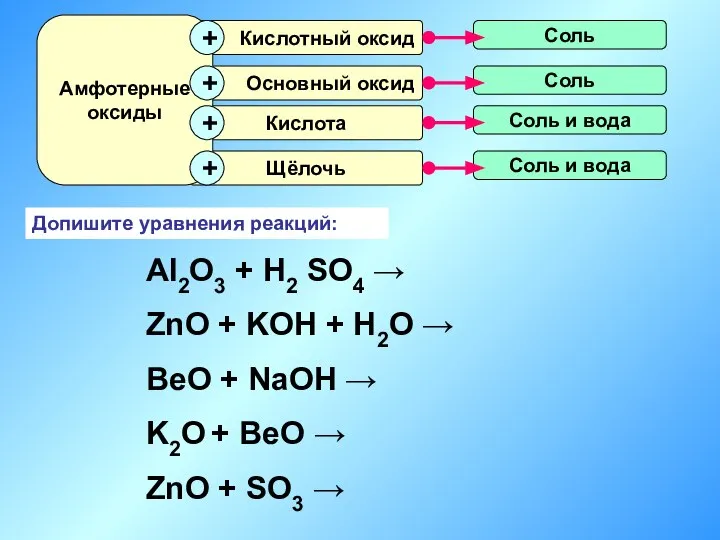
- 16. Допишите уравнения реакций: Al2O3 + H2 SO4 → ZnO + KOH + H2O → BeO +
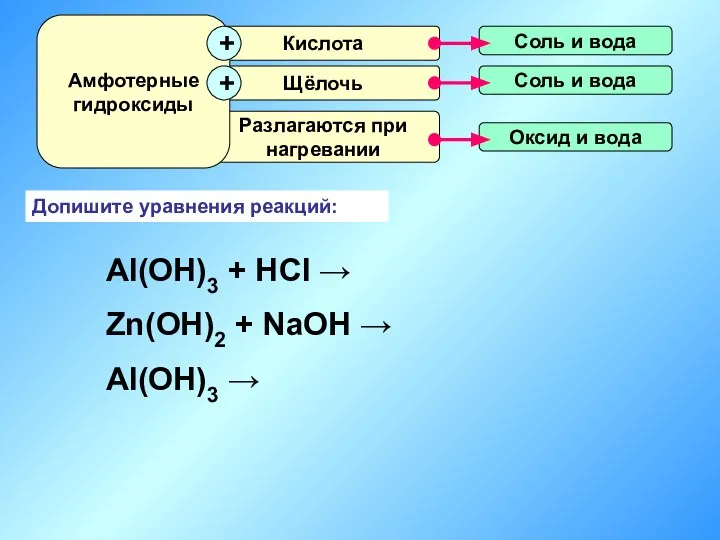
- 17. Допишите уравнения реакций: Al(OH)3 + HCl → Zn(OH)2 + NaOH → Al(OH)3 →
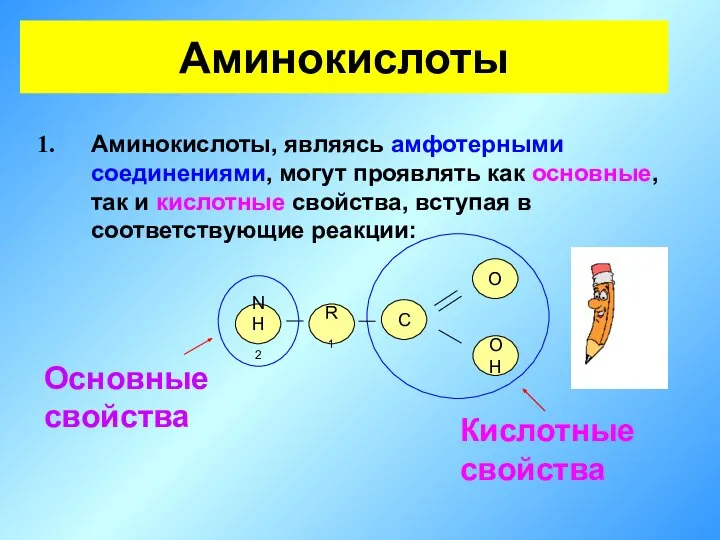
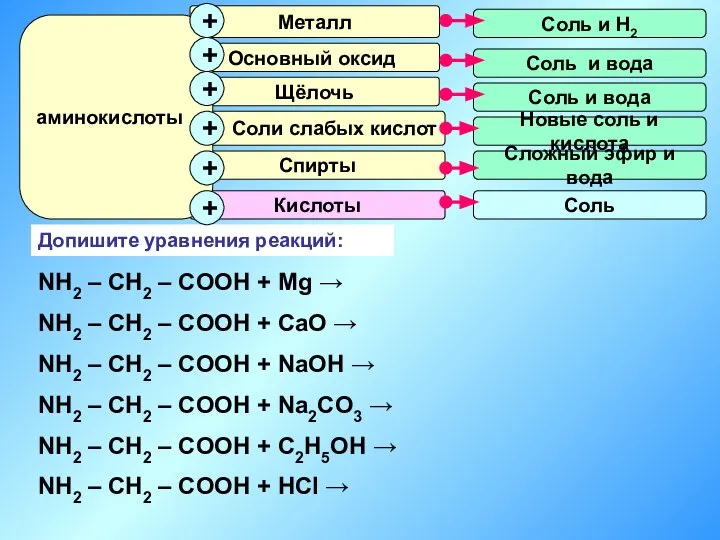
- 18. Аминокислоты Аминокислоты, являясь амфотерными соединениями, могут проявлять как основные, так и кислотные свойства, вступая в соответствующие
- 19. Допишите уравнения реакций: NH2 – CH2 – COOH + Mg → NH2 – CH2 – COOH
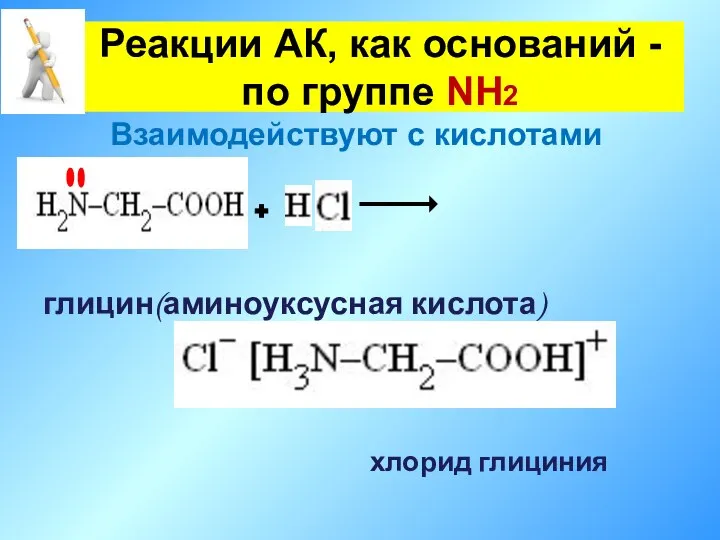
- 20. глицин(аминоуксусная кислота) хлорид глициния Реакции АК, как оснований - по группе NH2 Взаимодействуют с кислотами
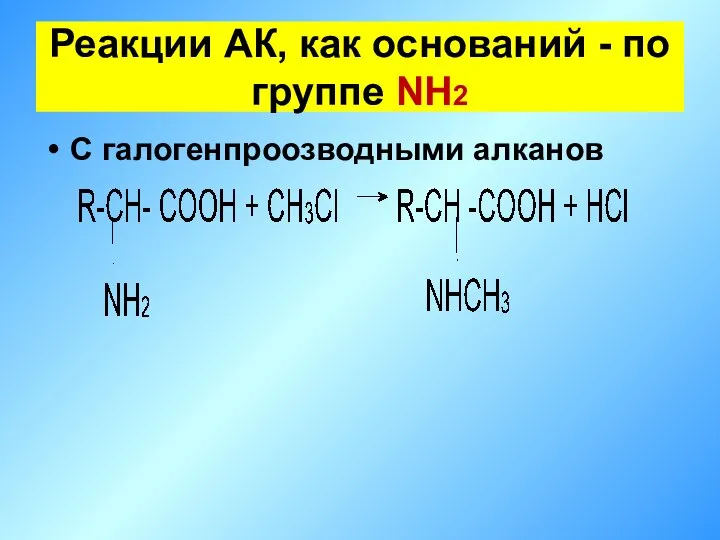
- 21. С галогенпроозводными алканов Реакции АК, как оснований - по группе NH2
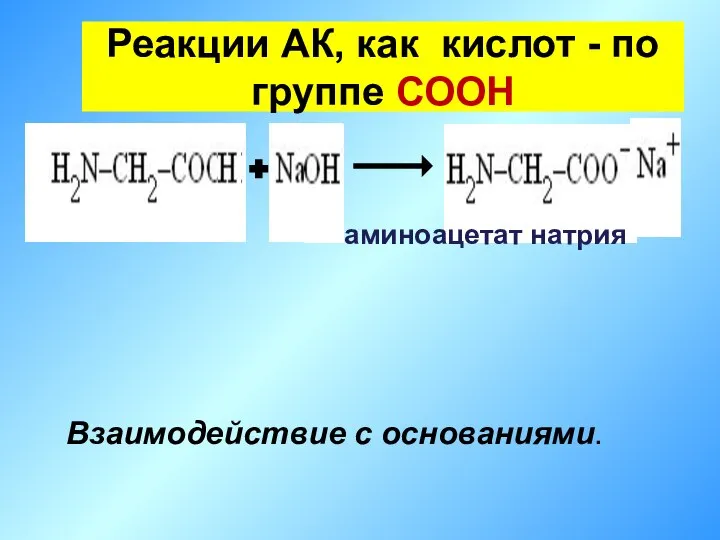
- 22. Реакции АК, как кислот - по группе СООН Взаимодействие с основаниями. аминоацетат натрия
- 23. Реакции АК, как кислот - по группе СООН Взаимодействуют с основными оксидами, так при нагревании проходит
- 24. Реакция этерификации со спиртами NH2CH2COOH + C2H5OH NH2CH2COOC2H5 + H2O H2SO4 (к) этиловый эфир аминоуксусной кислоты
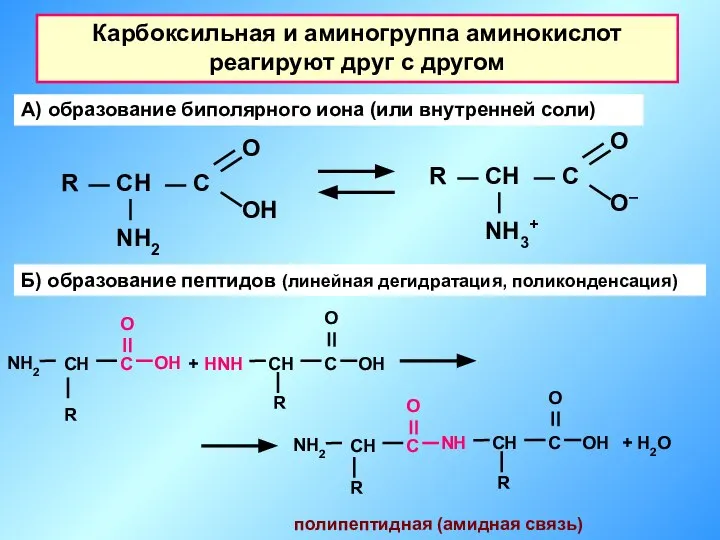
- 25. Карбоксильная и аминогруппа аминокислот реагируют друг с другом А) образование биполярного иона (или внутренней соли) Б)
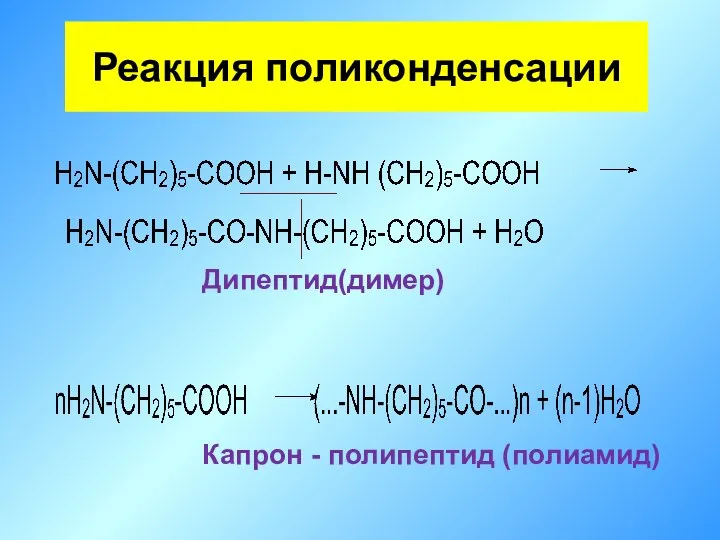
- 26. Дипептид(димер) Капрон - полипептид (полиамид) Реакция поликонденсации
- 28. Скачать презентацию







![Как кислота Al(OH)3+NaOH = Na[Al(OH)4] тетрагидроксоалюминат натрия Al(OH)3+OH- = [Al (OH)4] –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/974424/slide-9.jpg)
![Соли анионного типа устойчивы в щелочной среде, но разрушаются при подкислении растворов Na[Al(OH)4]+4HCl=NaCl+AlCl3+4H2O](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/974424/slide-10.jpg)






 Химические реакции
Химические реакции Классы неорганических соединений
Классы неорганических соединений Кристаллогидраты
Кристаллогидраты Конкурс юных химиков
Конкурс юных химиков Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Электрический ток в металлах
Электрический ток в металлах Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение
Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение Ķīmiskais līdzsvars un faktori, kas to ietekmē
Ķīmiskais līdzsvars un faktori, kas to ietekmē Неметаллы в природе и жизни человека
Неметаллы в природе и жизни человека Презентация на тему Удобрения и их классификация
Презентация на тему Удобрения и их классификация  Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами Амины. Классификация аминов
Амины. Классификация аминов Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа Dereglarea metabolismului
Dereglarea metabolismului Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Свойства воды
Свойства воды Протравка стекла с помощью ионного обмена
Протравка стекла с помощью ионного обмена Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы Витамины. (10 класс)
Витамины. (10 класс) Состав и свойства нефти
Состав и свойства нефти Соединения железа в природе
Соединения железа в природе 9 кл Урок 7 Розчинність речовин
9 кл Урок 7 Розчинність речовин Химическая связь и строение вещества
Химическая связь и строение вещества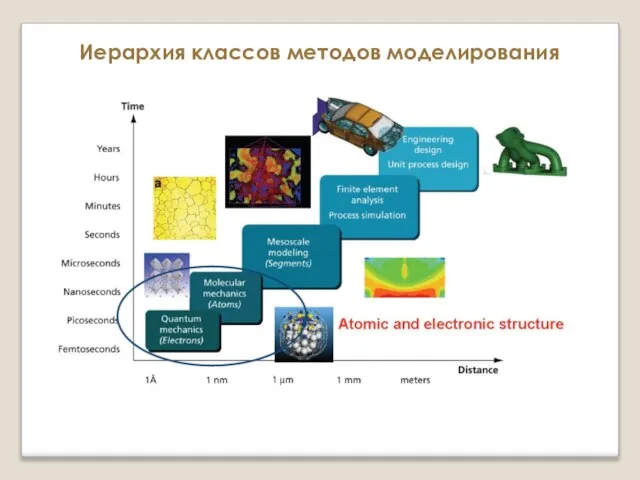 Атомистическое моделирование
Атомистическое моделирование Физическая химия
Физическая химия