Содержание
- 2. Аминокислоты Пептиды
- 3. Аминокислоты – основные структурные единицы, из которых построены молекулы белковых веществ. АМК - бифункциональные соединения, содержащие
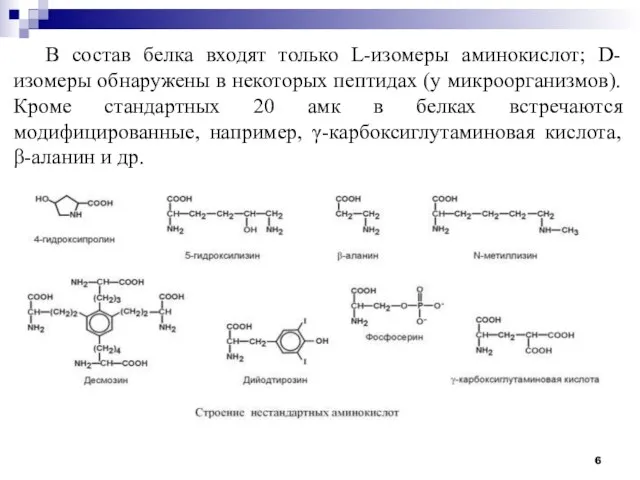
- 6. В состав белка входят только L-изомеры аминокислот; D-изомеры обнаружены в некоторых пептидах (у микроорганизмов). Кроме стандартных
- 7. Кислотно-основные свойства АМК Все амк в растворах существуют в виде биполярного иона (цвиттер-иона), эти вещества амфолиты.
- 8. В воде амк растворяются лучше, чем в других менее полярных растворителях. В водных растворах амк обладают
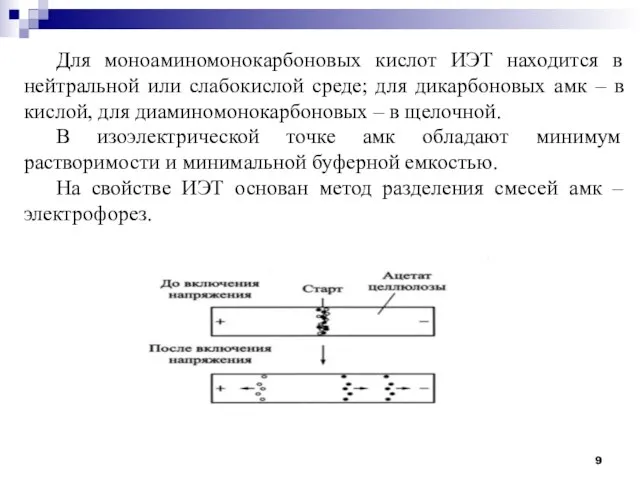
- 9. Для моноаминомонокарбоновых кислот ИЭТ находится в нейтральной или слабокислой среде; для дикарбоновых амк – в кислой,
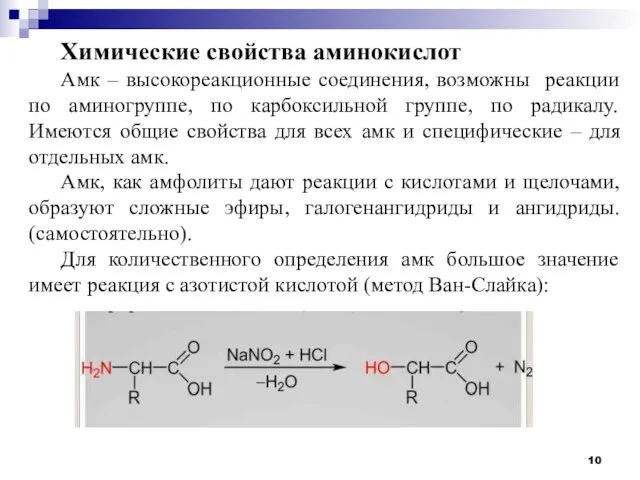
- 10. Химические свойства аминокислот Амк – высокореакционные соединения, возможны реакции по аминогруппе, по карбоксильной группе, по радикалу.
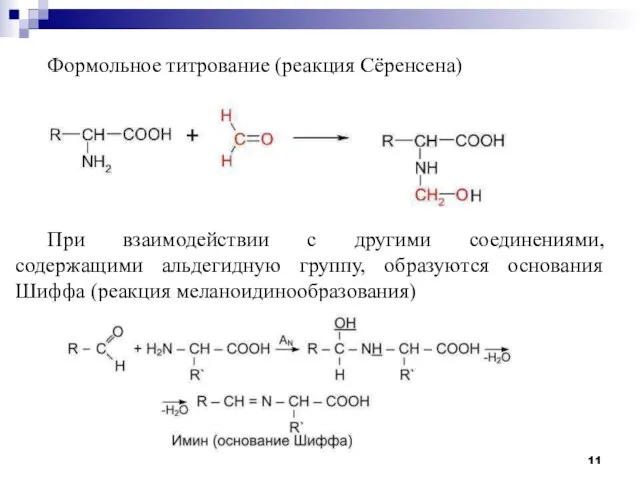
- 11. Формольное титрование (реакция Сёренсена) При взаимодействии с другими соединениями, содержащими альдегидную группу, образуются основания Шиффа (реакция
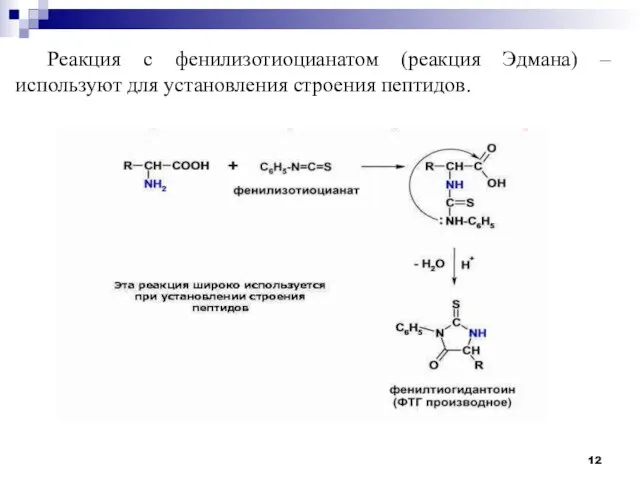
- 12. Реакция с фенилизотиоцианатом (реакция Эдмана) – используют для установления строения пептидов.
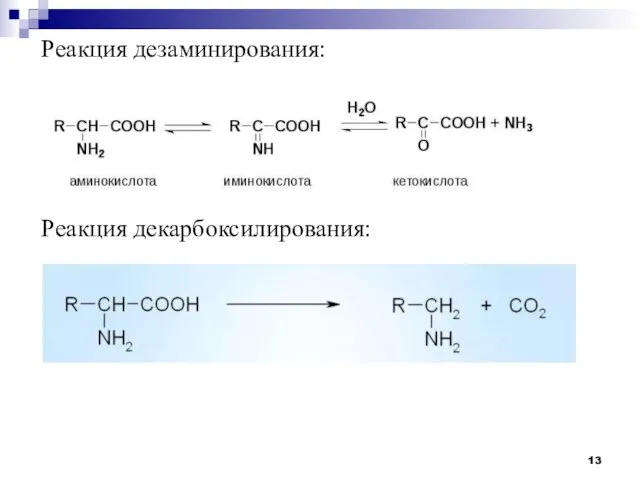
- 13. Реакция дезаминирования: Реакция декарбоксилирования:
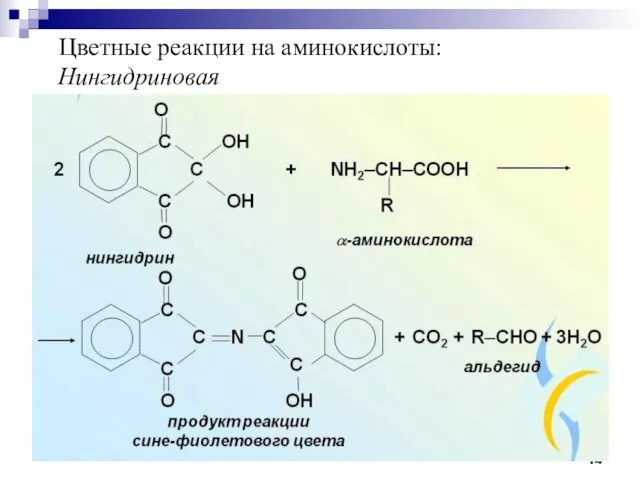
- 14. Цветные реакции на аминокислоты: Нингидриновая
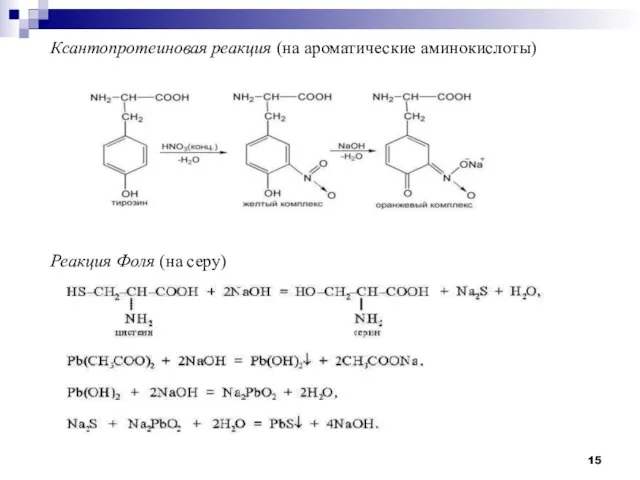
- 15. Ксантопротеиновая реакция (на ароматические аминокислоты) Реакция Фоля (на серу)
- 16. Реакция Адамкевича (на триптофан) при добавлении к раствору концентрированных уксусной и серной кислот образуется фиолетово-красное кольцо.
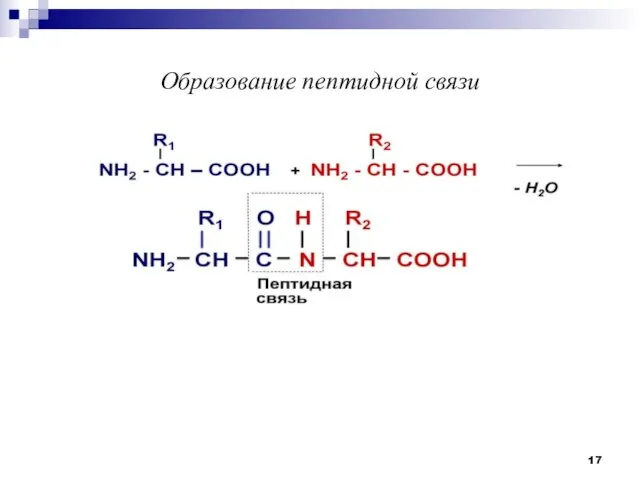
- 17. Образование пептидной связи
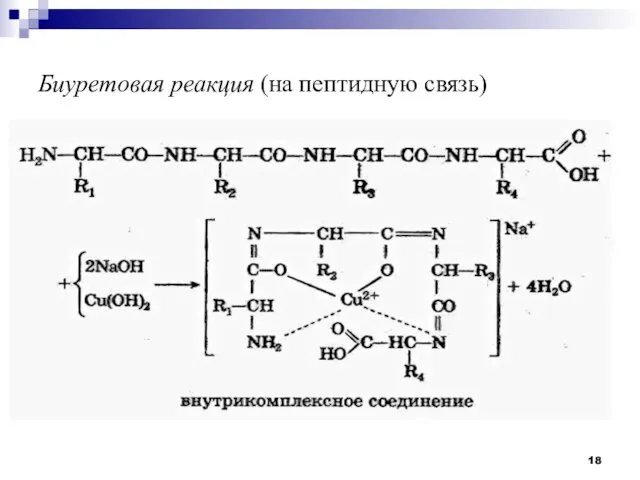
- 18. Биуретовая реакция (на пептидную связь)
- 19. Биологическое значение аминокислот Незаменимые амк – не могут быть синтезированы в организме человека и обязательно должны
- 20. Пептиды – это низкомолекулярные органические соединения, в которых аминокислоты связываются между собой пептидной или амидной связью
- 21. Глутатион – состоит из глутаминовой кислоты, цистеина и глицина, легко переходит из восстановленной в окисленную (S-S)
- 22. Еще один важный дипептид - карнозин Препятствует накоплению и устраняет продукты перекисного окисления липидов, участвует в
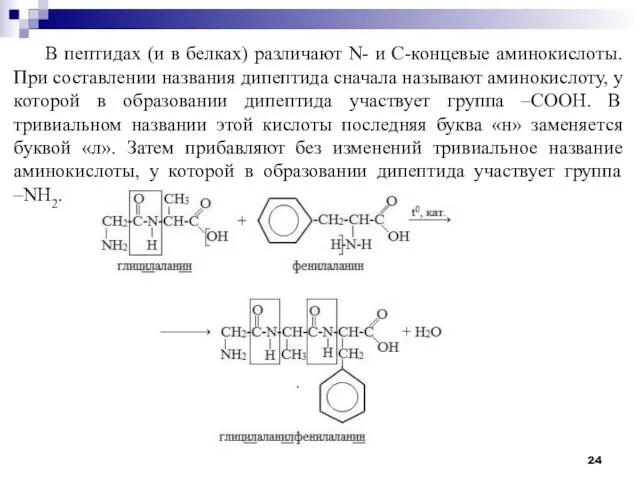
- 24. В пептидах (и в белках) различают N- и C-концевые аминокислоты. При составлении названия дипептида сначала называют
- 26. Скачать презентацию











 Типы химических реакций
Типы химических реакций Физико-химия полимеров
Физико-химия полимеров Бирюза. Характеристики минерала
Бирюза. Характеристики минерала Массовая доля растворенного вещества
Массовая доля растворенного вещества Белки
Белки Презентация на тему Витамин Е
Презентация на тему Витамин Е  Интрузивные контакты. Контакты интрузивных и осадочных пород
Интрузивные контакты. Контакты интрузивных и осадочных пород Физические и химические явления
Физические и химические явления Презентация на тему Неорганическая химия: подготовка к ГИА
Презентация на тему Неорганическая химия: подготовка к ГИА  Коррозия металлов
Коррозия металлов Процес сушіння тонкодисперсної пасти діоксиду титану
Процес сушіння тонкодисперсної пасти діоксиду титану Презентация на тему Железо и его соединения (9 класс)
Презентация на тему Железо и его соединения (9 класс)  Количество вещества
Количество вещества Степени окисления
Степени окисления Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа
Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия Ионная химическая связь
Ионная химическая связь Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера
Особенности строения ионных кристаллов. Постоянная Моделунга. Энергия кристаллической решётки. Цикл Борна-Габера Азот
Азот ЕГЭ по химии
ЕГЭ по химии proekt_TTU_15 (1)
proekt_TTU_15 (1) Решение задач на нахождение молекулярной формулы газообразного алкана
Решение задач на нахождение молекулярной формулы газообразного алкана Фосфор и его соединения. Минеральные удобрения
Фосфор и его соединения. Минеральные удобрения Сложные эфиры. Жиры
Сложные эфиры. Жиры Изомерия. Виды изомерии
Изомерия. Виды изомерии Раздел 1
Раздел 1 Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии