Содержание
- 21. Задачи на растворы 11 класс Уметь решать задачи есть искусство, преобращающееся с практикой. Д. Пойа
- 22. Задачи, связанные с изучением растворов, можно условно разделить на следующие группы: 1. вычисление массовой доли растворённого
- 23. Рассмотрим первое: вычисление массовой доли растворённого вещества (в процентах) и массы растворенного вещества Необходимо знать условные
- 24. Задачи на массовую долю 1)Сколько безводного карбоната натрия и воды надо взять, чтобы приготовить раствор массой
- 25. 3. Вычисление молярной концентрации раствора. Исходные уравнение для вычислений: С(р.в.) = n(р.в) / V(р-ра) или С(р.в.)
- 26. Вычисление молярной концентрации раствора 1)В воде растворили гидроксид натрия массой 21,4г. Объём раствора довели до 300
- 27. В воде растворили гидроксид натрия массой 21,4г. Объём раствора довели до 300 мл.. Определите молярную концентрацию
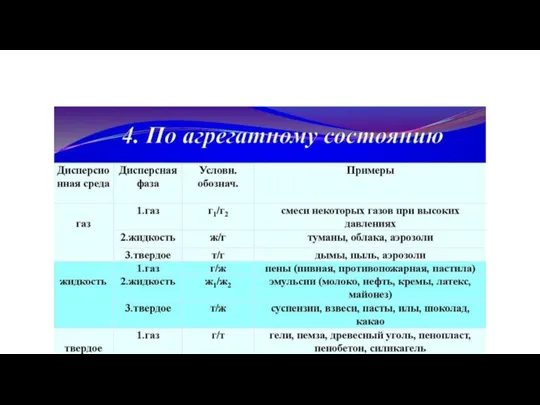
- 36. расположите данные вещества в таблице: Лак для волос, дым, минеральная вода, цветное стекло, мороженное, молоко, туман,
- 38. Скачать презентацию


































 Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Презентация на тему Получение галогенов. Биологическое значение и применение галогенов
Презентация на тему Получение галогенов. Биологическое значение и применение галогенов  Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли
Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли 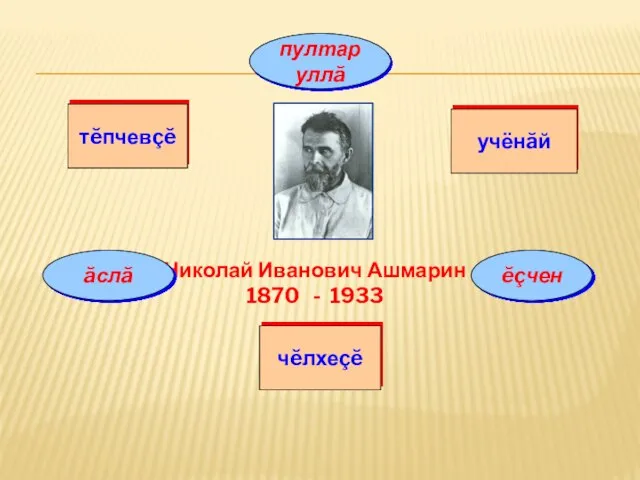 Пултаруллă
Пултаруллă Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Алканы: состав, строение, изомерия, номенклатура, получение
Алканы: состав, строение, изомерия, номенклатура, получение Алканы
Алканы Молярный объем газов
Молярный объем газов Химия неорганическая и органическая
Химия неорганическая и органическая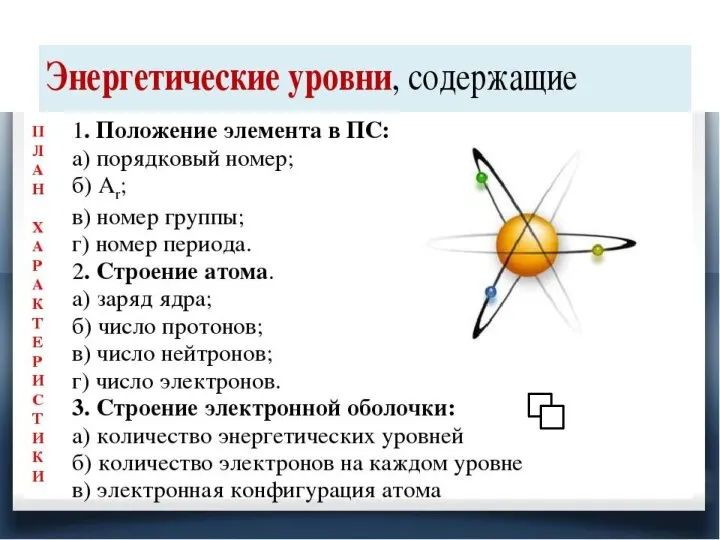 Закономерности изменения свойств атомов химических элементов
Закономерности изменения свойств атомов химических элементов Лекция 10. Неорганическая химия. Сероводород
Лекция 10. Неорганическая химия. Сероводород Условия преобразования органических веществ
Условия преобразования органических веществ Сплавы. 9 класс
Сплавы. 9 класс Семь доисторических металлов
Семь доисторических металлов Получение алканов
Получение алканов Общая характеристика МЕТАЛЛОВ
Общая характеристика МЕТАЛЛОВ Презентация на тему Сведения о воде
Презентация на тему Сведения о воде  Кислоты
Кислоты Классификация реагентов и реакций в органической химии. (Лекция 4)
Классификация реагентов и реакций в органической химии. (Лекция 4) Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40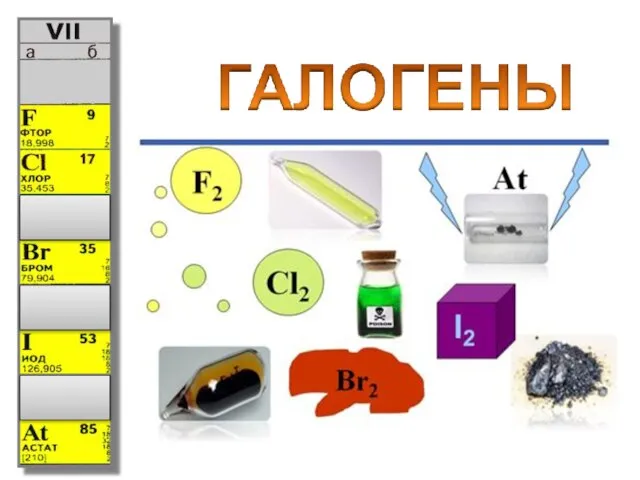 Общая характеристика элементов VIIa группы
Общая характеристика элементов VIIa группы Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению
Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии Закон сохранения массы и химические уравнения
Закон сохранения массы и химические уравнения Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс Щелочные металлы
Щелочные металлы Степень окисления
Степень окисления