Содержание
- 2. Бериллий, магний и щелочноземельные металлы ДОМАШНЕЕ ЗАДАНИЕ: § 15, УПР 3,5 (СТР. 106)
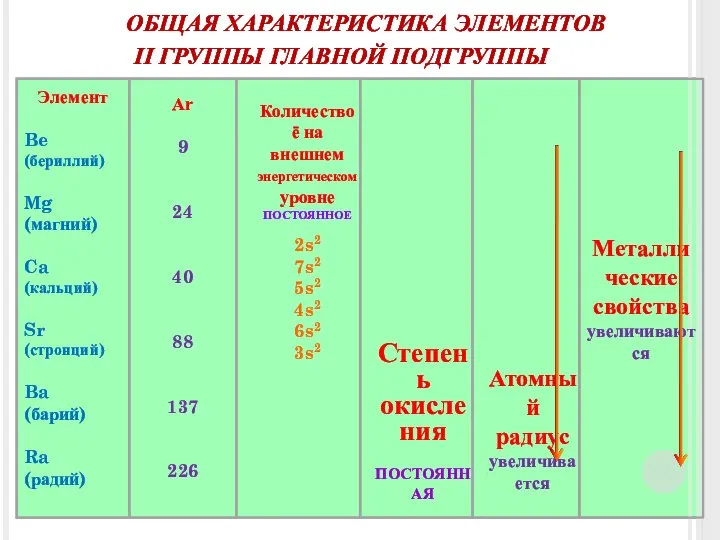
- 3. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ Элемент Be (бериллий) Mg (магний) Ca (кальций) Sr (стронций) Ba (барий) Ra (радий)
- 4. В природе ЩЗ металлы в самородном состоянии не встречаются. Самые распространенный из них – магний и
- 5. ФИЗИЧЕСКИЕ СВОЙСТВА бериллий кальций стронций магний
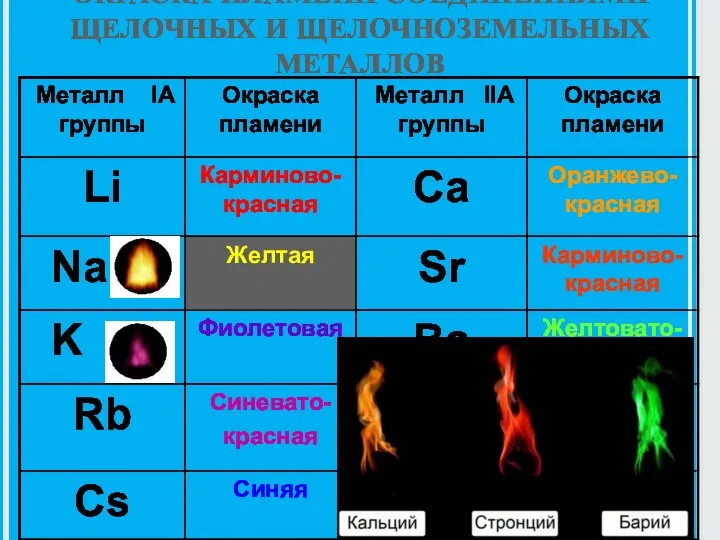
- 6. ОКРАСКА ПЛАМЕНИ СОЕДИНЕНИЯМИ ЩЕЛОЧНЫХ И ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
- 7. ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ I. Взаимодействие с неметаллами 1.С кислородом: 2Mе+O2=2MеO (оксид) 2Mg + O2 =
- 8. II. Взаимодействие с водой Ме + 2Н2О = Mе(OH)2 + H2 (Be, Мg – медленно, при
- 9. Магнийтермия – восстановление редких металлов из их оксидов магнием 2Mg + TiO2 = 2MgO +Ti Кальцийтермия
- 10. ЩЕЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ-ЭЛЕМЕНТЫ IIA ГРУППЫ Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция
- 11. ОКСИДЫ И ГИДРОКСИДЫ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ – ПРОЯВЛЯЮТ ОСНОВНЫЕ СВОЙСТВА Оксид кальция Гидроксид кальция
- 12. ЖЕСТКОСТЬ ВОДЫ
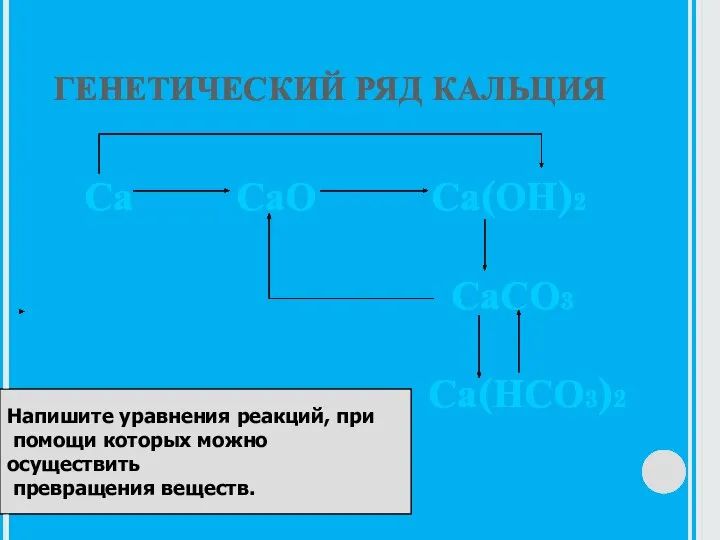
- 15. ГЕНЕТИЧЕСКИЙ РЯД КАЛЬЦИЯ Са СаО Са(ОН)2 СаСО3 Са(НСО3)2 Напишите уравнения реакций, при помощи которых можно осуществить
- 16. КАЛЬЦИЙ –ТИПИЧНЫЙ ПРЕДСТАВИТЕЛЬ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ Дайте названия соединениям кальция: CaO Ca(OH)2 CaCO3 CaHCO3 Вспомните тривиальные названия
- 17. Ca
- 18. Как называются отложения, свисающие в виде гигантских сосулек со свода пещеры? А растущие навстречу им со
- 19. Mg
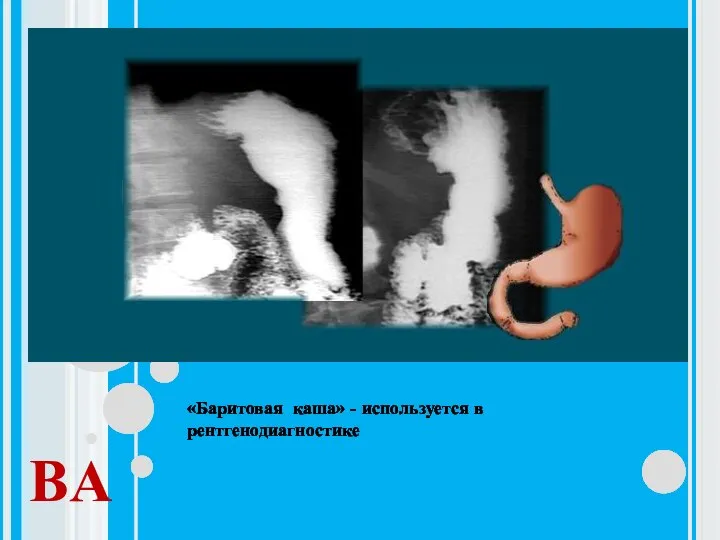
- 20. BA «Баритовая каша» - используется в рентгенодиагностике
- 21. ПРОДОЛЖИТЕ ВЫСКАЗЫВАНИЕ. 1. Оксид кальция получают в промышленности: а) при разложении сульфата кальция; б) Взаимодействием кальция
- 22. 1.Наиболее выраженные металлические свойства проявляет: а) Al; б) Mg; в) Сa; г) Be. 2. Химическая реакция
- 24. Скачать презентацию

















 Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Химия в моей специальности
Химия в моей специальности Вывод формул химических веществ
Вывод формул химических веществ Химический состав мембран. Лабораторная работа № 1
Химический состав мембран. Лабораторная работа № 1 Химия. 8 класс
Химия. 8 класс Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Тест по теме Спирты. Фенол
Тест по теме Спирты. Фенол Характеристика кислорода и серы
Характеристика кислорода и серы Общая характеристика металлов
Общая характеристика металлов Презентация на тему Самородки 9 класс
Презентация на тему Самородки 9 класс  Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Кислоты. Классификация кислот (8 класс)
Кислоты. Классификация кислот (8 класс) Сахароза, крахмал, целлюлоза
Сахароза, крахмал, целлюлоза Углеводы
Углеводы Презентация на тему Подготовка к ГИА по химии
Презентация на тему Подготовка к ГИА по химии  Презентация на тему Лайнус Полинг
Презентация на тему Лайнус Полинг  Контроль знаний на уроках химии
Контроль знаний на уроках химии Халькогены. Электронное строение кислорода и серы
Халькогены. Электронное строение кислорода и серы Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Сплавы цветных металлов
Сплавы цветных металлов Моющие и чистящие средства
Моющие и чистящие средства Химические явления
Химические явления Энергетика хим процессов
Энергетика хим процессов Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач
Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач Химические свойства металлов
Химические свойства металлов Консультация по химии
Консультация по химии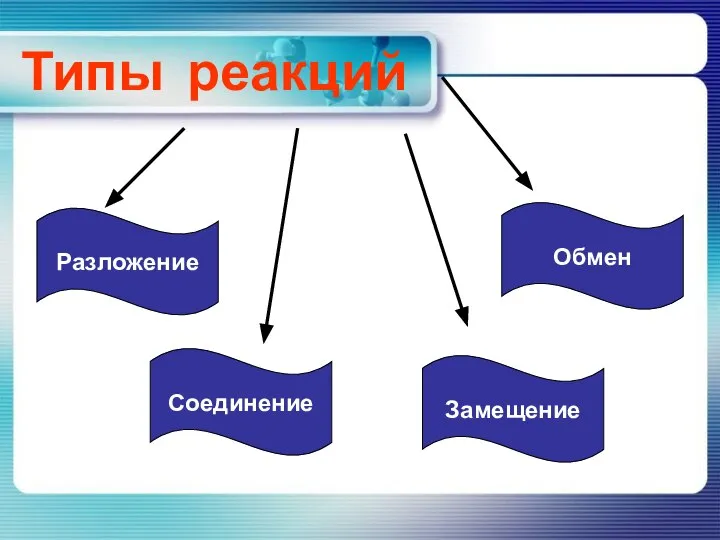 Реакции разложения
Реакции разложения