Содержание
- 2. Парацетамол Приветик всем! Я парацетамол! От жара и озноба я вас спасти готов! Я боль сниму
- 3. 80 % лекарственных препаратов изготавливаются на основе анилина и аминов.
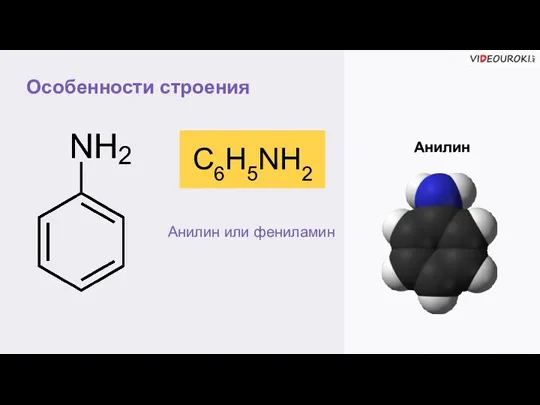
- 4. Особенности строения Анилин С6H5NH2 Анилин или фениламин
- 5. Физические свойства анилина бесцветная маслянистая жидкость; с характерным запахом; мало растворим в воде; Анилин: Анилин хорошо
- 6. Химические свойства анилина Реакции с кислотами С6H5NH2 + HCl → [С6H5NH3]+ Cl- Хлорид фениламмония Амины –
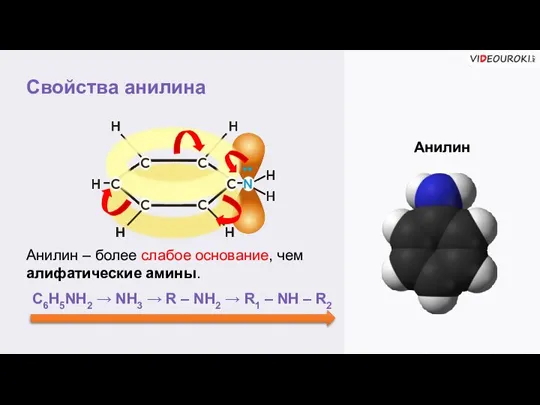
- 7. Свойства анилина Анилин Анилин – более слабое основание, чем алифатические амины. •• C6H5NH2 → NH3 →
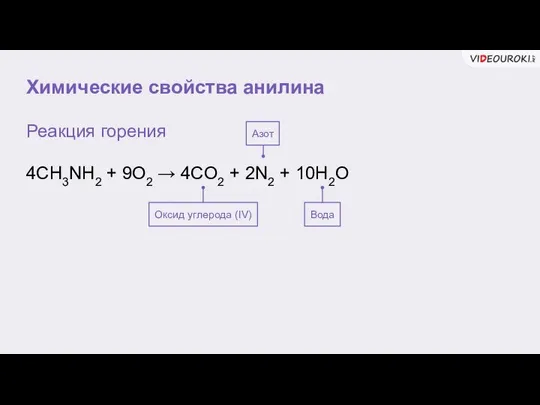
- 8. Химические свойства анилина Реакция горения 4CH3NH2 + 9O2 → 4CO2 + 2N2 + 10H2O Оксид углерода
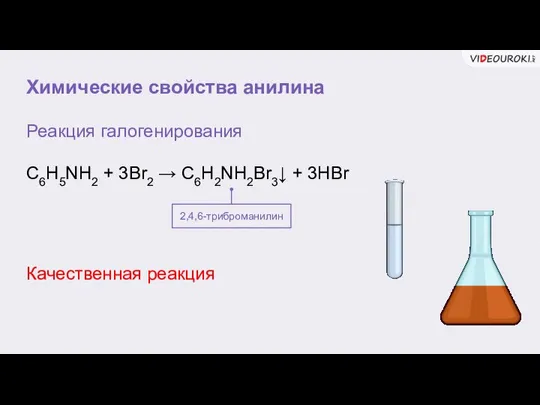
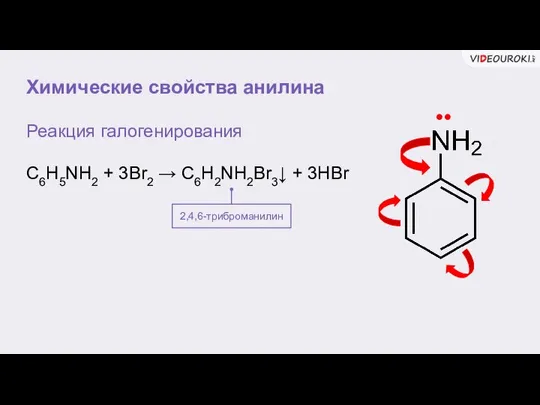
- 9. Химические свойства анилина Реакция галогенирования C6H5NH2 + 3Br2 → C6H2NH2Br3↓ + 3HBr 2,4,6-триброманилин Качественная реакция
- 10. Химические свойства анилина Реакция галогенирования C6H5NH2 + 3Br2 → C6H2NH2Br3↓ + 3HBr 2,4,6-триброманилин ••
- 11. Ацетанилид использовали как первое синтетическое жаропонижающее средство.
- 12. Сульфаниловую кислоту используют как промежуточное вещество в синтезе лекарственных средств и красителей.
- 13. С древних времён люди использовали природный краситель синего цвета – индиго.
- 14. Иоганн Фридрих Вильгельм Адольф фон Байер (1835–1917 гг.) Адольф Байер — немецкий химик, профессор Страсбургского и
- 15. Иоганн Фридрих Вильгельм Адольф фон Байер (1835–1917 гг.) Исследовал реакции конденсации. Лауреат Нобелевской премии. Изучал многие
- 16. Юлий Фёдорович Фрицше (1808–1871 гг.) В 1840 году обнаружил, что при нагревании со щёлочью синяя окраска
- 17. Николай Николаевич Зинин (1812–1880 гг.) В 1841 году Зинин открыл способ восстановления нитробензола до ароматического амина
- 18. Август Вильгельм Гофман (1818–1892 гг.) В 1843 году Гофман пришёл к выводу, что все эти продукты
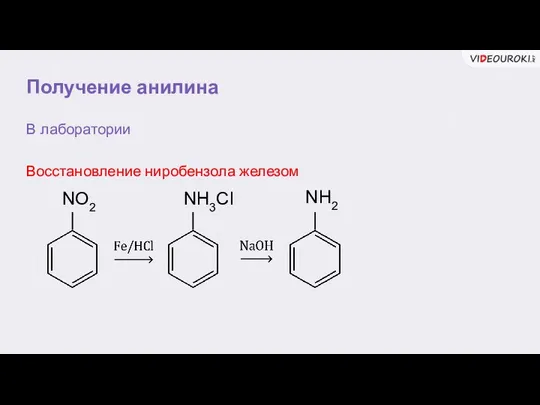
- 19. Получение анилина В лаборатории Восстановление ниробензола железом NO2 NH3Cl NH2
- 20. Получение анилина В промышленности Реакция Зинина NO2 NH2 + 6[H]
- 21. Применение анилина Красители Лекарства Взрывчатые вещества
- 22. Вычислите массу бромной воды с массовой долей брома 3 %, которая потребуется для полного взаимодействия с
- 24. Скачать презентацию



![Химические свойства анилина Реакции с кислотами С6H5NH2 + HCl → [С6H5NH3]+ Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/939948/slide-5.jpg)








![Получение анилина В промышленности Реакция Зинина NO2 NH2 + 6[H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/939948/slide-19.jpg)


 Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Химия и сельское хозяйство
Химия и сельское хозяйство Валентность. Составление формул по валентности
Валентность. Составление формул по валентности Гидролиз солей
Гидролиз солей Химические уравнения
Химические уравнения Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Полиуретановые полимеры
Полиуретановые полимеры Кремнийорганическая гипотеза
Кремнийорганическая гипотеза Бикомпонентные покрытия
Бикомпонентные покрытия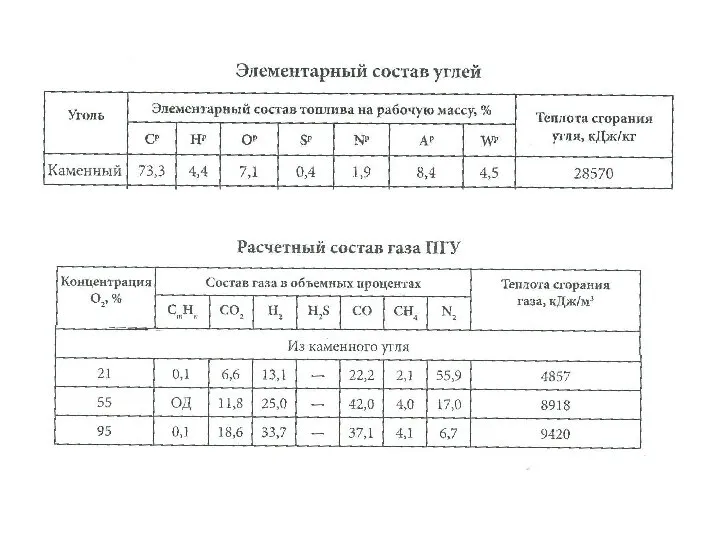 Элементарный состав углей
Элементарный состав углей Своя игра по химии
Своя игра по химии Классификация химических реакций
Классификация химических реакций Смог як хімічне явище
Смог як хімічне явище Влияние катализаторов на реакционную систему на примере синтеза Фишера-Тропша
Влияние катализаторов на реакционную систему на примере синтеза Фишера-Тропша К решению задач по диссоциации
К решению задач по диссоциации proverochnaya_zadachi_1_ball_-_kopia (1)
proverochnaya_zadachi_1_ball_-_kopia (1) Презентация на тему Алмаз, графит и фуллерен
Презентация на тему Алмаз, графит и фуллерен  Нефть. Состав и свойства
Нефть. Состав и свойства Спирты
Спирты Изомерия. Виды изомерии
Изомерия. Виды изомерии Нефть и продукты ее переработки. Лабораторная работа
Нефть и продукты ее переработки. Лабораторная работа Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире Соли
Соли Нефть. Способы переработки нефти
Нефть. Способы переработки нефти способы разделения смесей
способы разделения смесей Процесс диссоциации
Процесс диссоциации Дифференцированный подход в преподавании химии
Дифференцированный подход в преподавании химии Окислительно-восстновительные реакции
Окислительно-восстновительные реакции