Содержание
- 2. Алюминий Al 27 +13 0 2 8 3 P = 13 e = 13 N =
- 3. Алюминий- металл, но не типичный, его восстановительные св-ва выражены слабее, чем у щелочных и щелочно- земельных
- 4. Физические свойства Серебристо - белый металл, легкий, но прочный, очень пластичный, хорошо проводит электрический ток и
- 5. Химические свойства С О2 (только при нагревании) 4Al + 3O2 = 2Al2O3 2) С др. не
- 6. 3) С водой реагирует только при удалении оксидной пленки. 2Al + 6H2O = 2Al(OH)3 + 3H2
- 7. 8Al + 30HNO3(разб) = 8Al(NO3)3 + 99H20+ +3NH4NO3 5) Взаим с раствором щелочей 2Al + 6H2O
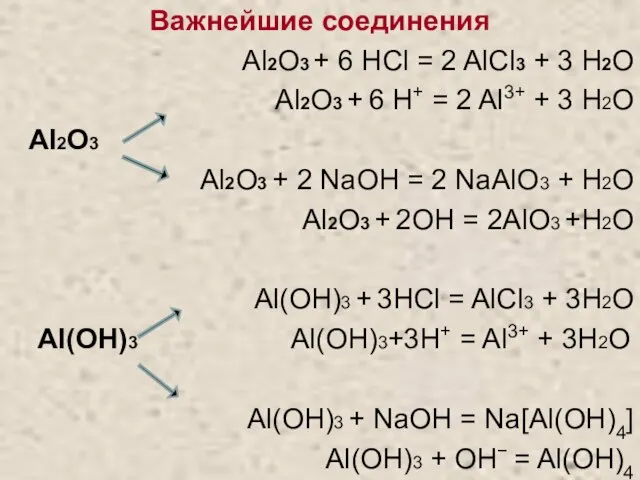
- 8. Важнейшие соединения Al2O3 + 6 HCl = 2 AlCl3 + 3 H2O Al2O3 + 6 H+
- 9. Получение 1)Электролиз Al2O3 : Al2O3 2 Al3+ + 3 O2- K(-): 2Al3+ +3e → 2Al0 2
- 10. Вопросы 1)С какими из указанных в-в реагирует алюминий? А) СaO Б) HCl B) Cl2 Г) NaOH
- 11. 4) Какие из указанных металлов являются более активными, чем алюминий ? А) Na Б) Cu В)
- 13. Скачать презентацию









 Методы защиты металлов от электрохимической коррозии. Классификация методов защиты
Методы защиты металлов от электрохимической коррозии. Классификация методов защиты Кроссворд первоначальные понятия
Кроссворд первоначальные понятия Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Арены. Бензол
Арены. Бензол Ovr-1
Ovr-1 Турнир знатоков химии
Турнир знатоков химии Классификация методов аналитической химии
Классификация методов аналитической химии 2.Химич. м-ды колич. ан-за
2.Химич. м-ды колич. ан-за Фосфор и его соединения
Фосфор и его соединения Карбоновые кислоты
Карбоновые кислоты Аммиак
Аммиак Химические реакции. Подготовка к контрольной работе №2
Химические реакции. Подготовка к контрольной работе №2 Химическая связь
Химическая связь Исследование коррозии и создание антикоррозийного состава
Исследование коррозии и создание антикоррозийного состава Криогенный разрыв пласта
Криогенный разрыв пласта Презентация по Химии "Строении атомов. Химическая связь"
Презентация по Химии "Строении атомов. Химическая связь"  Особо чистые вещества. Занятие13
Особо чистые вещества. Занятие13 Задачи на ионные равновесия
Задачи на ионные равновесия Основания. Структурная формула
Основания. Структурная формула Хлор. Нахождение в природе
Хлор. Нахождение в природе Презентация на тему Гидролиз солей
Презентация на тему Гидролиз солей  Презентация на тему Использование Икт в преподавании химии
Презентация на тему Использование Икт в преподавании химии  Молекулярная химия
Молекулярная химия Валентность. Нахождение химической формулы вещества по валентности
Валентность. Нахождение химической формулы вещества по валентности Презентация на тему Кристаллы
Презентация на тему Кристаллы  Химические свойства амфотерных оксидов и гидроксидов
Химические свойства амфотерных оксидов и гидроксидов Азотная кислота
Азотная кислота Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций