Содержание
- 2. Дать характеристику элементам IA группы по их положению в периодической системе химических элементов. На основе строения
- 3. Щелочные металлы
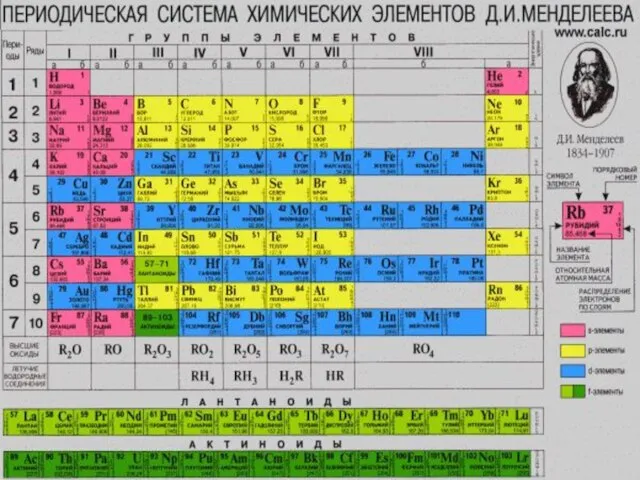
- 5. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ Li Na K Rb Cs Fr 7 23 39
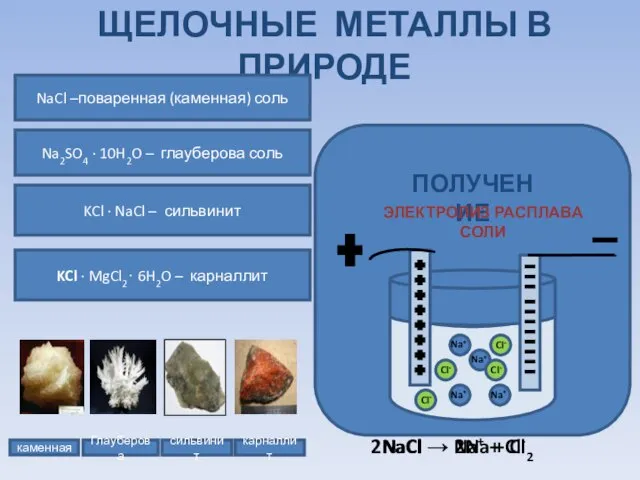
- 6. ЩЕЛОЧНЫЕ МЕТАЛЛЫ В ПРИРОДЕ каменная Глауберова сильвинит карналлит NaCl –поваренная (каменная) соль Na2SO4 ∙ 10H2O –
- 7. ФИЗИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ МЕТАЛЛИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Вещества серебристо-белого цвета Электропроводны и теплопроводны Легкоплавкие. пластичные t
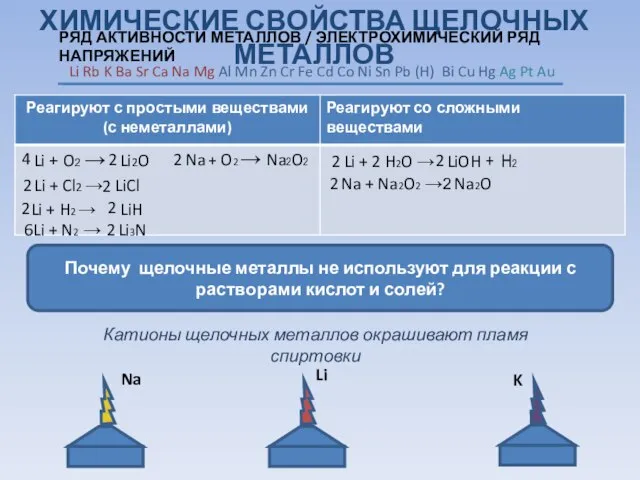
- 8. ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧНЫХ МЕТАЛЛОВ Почему щелочные металлы не используют для реакции с растворами кислот и солей?
- 9. БИОЛОГИЧЕСКАЯ РОЛЬ И ПРИМЕНЕНИЕ СОЕДИНЕНИЙ КАЛИЯ И НАТРИЯ ответ ответ ответ NaCl Кристалли-ческая сода Na2CO3*10H2O Питьевая
- 10. Проверь себя: ☺ Вычеркните неверное суждение о щелочных металлах: 1. Число электронов на внешнем энергетическом уровне
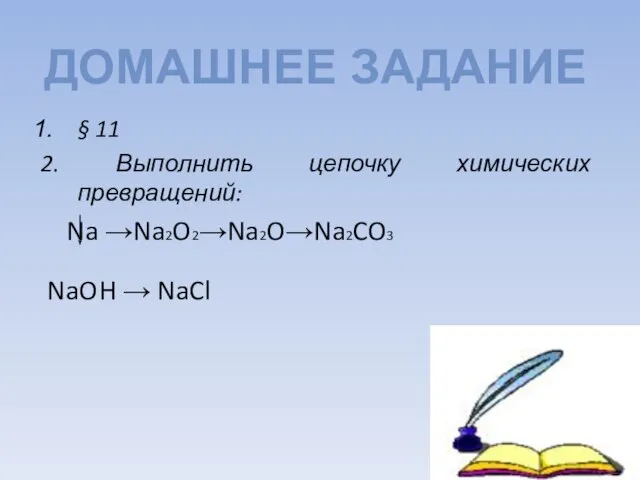
- 11. § 11 2. Выполнить цепочку химических превращений: Na →Na2O2→Na2O→Na2CO3 NaOH → NaCl ДОМАШНЕЕ ЗАДАНИЕ
- 12. СПАСИБО ЗА УРОК!!!
- 14. Скачать презентацию







 Химический футбол на тему: Химия вокруг нас
Химический футбол на тему: Химия вокруг нас Диссоциация. Уравнения диссоциации
Диссоциация. Уравнения диссоциации Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Химическая промышленность. Аварии на химических предприятиях
Химическая промышленность. Аварии на химических предприятиях Виды аккумулирования энергии
Виды аккумулирования энергии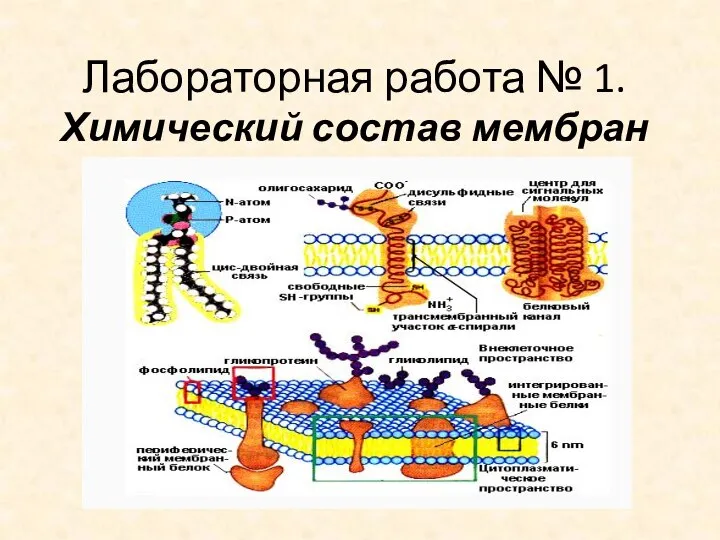 Химический состав мембран. Лабораторная работа № 1
Химический состав мембран. Лабораторная работа № 1 Удельная теплота сгорания
Удельная теплота сгорания Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь
Природные источники углеводородов. Природный и попутный нефтяные газы. Нефть. Каменный уголь Электролитическая диссоциация
Электролитическая диссоциация Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста
Арены. Понятие ароматичности. Правило Хюкклея. Круг Фроста Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Кремний и его соединения
Кремний и его соединения Презентация на тему Водород (8 класс)
Презентация на тему Водород (8 класс)  Презентация на тему Типы химических реакций (8 класс)
Презентация на тему Типы химических реакций (8 класс)  Химия в нашей жизни
Химия в нашей жизни Алканы. Строение. Изомерия и номенклатура
Алканы. Строение. Изомерия и номенклатура Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4
Решение экспериментальных задач по теме Основные классы неорганических соединений. Практическая работа № 4 Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В.
Учитель химии МАОУ СОШ № 61 города Тюмени Белова Н.В. Презентация на тему Основные химические понятия
Презентация на тему Основные химические понятия  Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Окислители в пиросоставах
Окислители в пиросоставах Основания. Определение. Формулы
Основания. Определение. Формулы Презентация на тему Элементы таблицы Менделеева
Презентация на тему Элементы таблицы Менделеева  Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Презентация на тему Чистые вещества и смеси
Презентация на тему Чистые вещества и смеси  Процесс диссоциации
Процесс диссоциации Основания (Ме+n(ОН)-n)
Основания (Ме+n(ОН)-n) Альдегиды. Строение молекулы альдегида. Номенклатура и изомерия
Альдегиды. Строение молекулы альдегида. Номенклатура и изомерия