Содержание
- 2. МЕДИЦИНСКАЯ ХИМИЯ – объединяет закономерности всех разделов химии для изучения химической стороны физиологических процессов, лекарственной, гигиенической
- 3. Физическая химия изучает взаимосвязь химических и физических явлений. Химические реакции всегда связаны с разнообразными физическими процессами:
- 4. ТЕРМОДИНАМИКА изучает энергетику физических, физико-химических, химических процессов и отвечает на вопросы: возможен ли процесс и в
- 5. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ Предметом классической термодинамики является изучение законов взаимных превращений различных видов энергии,
- 6. В зависимости от характера взаимодействия с окружающей средой различают системы: ОТКРЫТЫЕ – обмениваются с окружающей средой
- 7. Термодинамическое РАВНОВЕСНОЕ состояние, которое характеризуется постоянством всех свойств во времени в любой точке системы и отсутствием
- 8. ИНТЕНСИВНЫЕ параметры или основные параметры состояния - параметры, которые поддаются непосредственному измерению, не зависят от числа
- 9. В зависимости от изменения параметров системы процессы разделяют на: изотермические Т=const, ∆T = 0 изохорические V=const
- 10. Термодинамический процесс вызывает энергетические изменения в системе, которые выражаются через изменение определенных величин: внутренней энергии, теплоты,
- 11. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ТЕРМОХИМИЯ. Первый закон ТД – всеобщий закон природы, закон сохранения и превращения энергии.
- 12. 1. В изобарных условиях ( P = Const) Qp= ΔH Следствия из первого начала ТД 2.
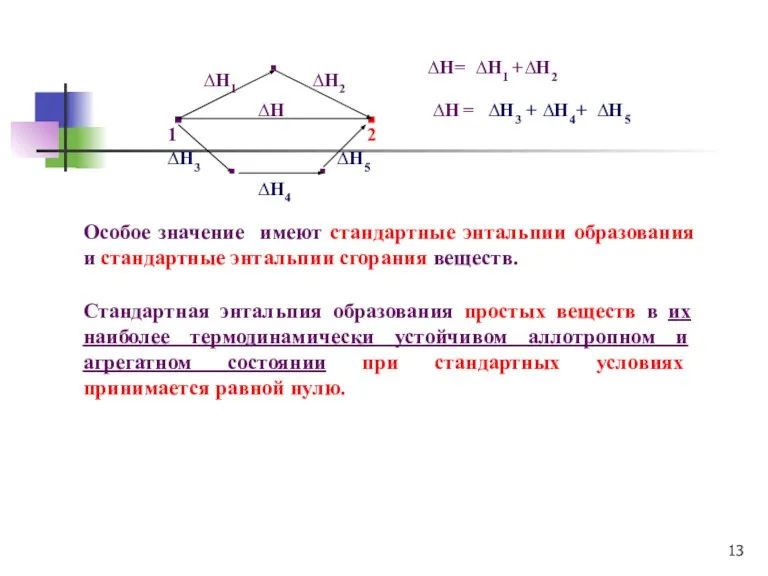
- 13. 1 ▪ ▪ ∆H 2 ▪ ∆H2 ∆H1 ▪ ▪ ∆H3 ∆H4 ∆H5 ∆H= ∆H3 +
- 14. Cледствия из закона Гесса. Стандартная энтальпия сгорания вещества равна энтальпии реакции сгорания 1 моль вещества при
- 15. 3. Энтальпия прямой реакции равна энтальпии обратной реакции, но с противоположным знаком
- 16. Калорийностью питательных веществ называется энергия, выделяемая при полном окислении 1 г питательных веществ. 1 калория =
- 18. Скачать презентацию














 коррозия металлов
коррозия металлов Презентация на тему Природные источники углеводородов
Презентация на тему Природные источники углеводородов  Шаблон презентации по химии
Шаблон презентации по химии Положение металлов в периодической системе химических элементов
Положение металлов в периодической системе химических элементов Производство чугуна и стали
Производство чугуна и стали Химия и география. Блиц-опрос. 7 класс
Химия и география. Блиц-опрос. 7 класс Расстворение. Расстворы
Расстворение. Расстворы Физические и химические явления 8 класс Учитель химии Кузнецова А.Н.
Физические и химические явления 8 класс Учитель химии Кузнецова А.Н. Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Вода – уникальное вещество на планете Земля
Вода – уникальное вещество на планете Земля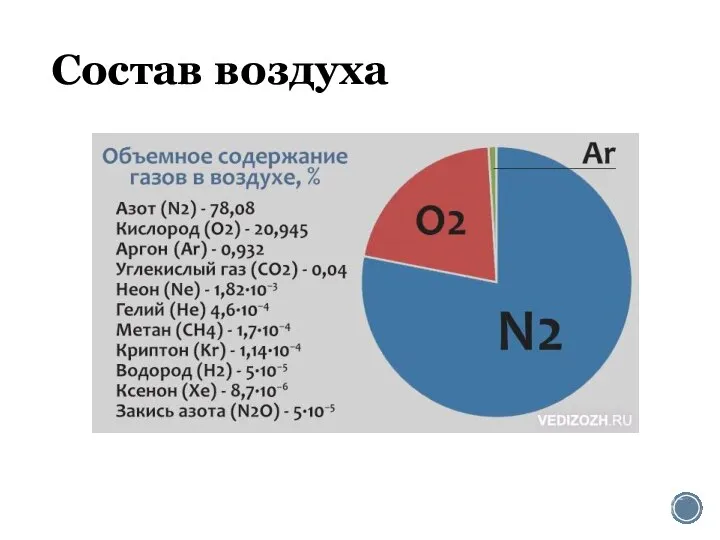 Состав воздуха. Азот
Состав воздуха. Азот Алюминий. Из истории открытия
Алюминий. Из истории открытия Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Ковалентная неполярная химическая связь
Ковалентная неполярная химическая связь Коррозия металлов. Лекция №8
Коррозия металлов. Лекция №8 Готовимся к ЕГЭ по органической химии Ароматические углеводороды
Готовимся к ЕГЭ по органической химии Ароматические углеводороды Валентность химических элементов
Валентность химических элементов Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Количество вещества. Моль. Молярная масса
Количество вещества. Моль. Молярная масса Наноматериалы и нанотехнологии
Наноматериалы и нанотехнологии Железо Fe. Строение атома
Железо Fe. Строение атома Опыты с хондроитин сульфатом
Опыты с хондроитин сульфатом Альдегиды и кетоны
Альдегиды и кетоны Сколько нужно чистого белка
Сколько нужно чистого белка Химия и автомобиль
Химия и автомобиль Презентация на тему Соединения серы
Презентация на тему Соединения серы  Краски своими руками. Проектная работа
Краски своими руками. Проектная работа Клуб юных химиков. Школа №3
Клуб юных химиков. Школа №3