Содержание
- 2. Ароматичность карбоциклических соединений Ароматичность – способность некоторых непредельных соединений легко вступать в реакции замещения, устойчивость к
- 3. Современное представление о строении атома бензола 6 Атомов углерода, связанные друг с другом сигма-связями одинаковой длины
- 4. Правило Хюккеля В 1931 г. Хюккель на основании квантово-механических расчётов сформулировал правило, гласящее, что соединение должно
- 5. Номенклатура и изомерия углеводородов ряда бензола Общая формула гомологического ряда бензола CnH2n-6 Первый гомолог бензола –
- 6. Радикалы ароматических углеводородов – арилы (Ar) Радикал (остаток) бензола С6Н5 - фенил и часто обозначается Ph;
- 7. Называя сложные производные бензола выбирают тот порядок нумерации, при котором сумма цифр номеров заместителей будет наименьшей;
- 8. Методы получения аренов 1. Переработка нефти. В большом колличестве углеводороды этого ряда содержатся в некоторых сортах
- 9. Физические свойства Низшие члены гомологического ряда бензола – бесцветные жидкости с характерным запахом. Плотность и показатель
- 10. Индуктивный и мезомерный эффект Индуктивный эффект – смещение электронной плотности в молекуле вдоль сигма-связи под влиянием
- 11. Положительные и отрицательные электронные эффекты заместителей Отрицательный электронный эффект (-J, -М) Заместитель оттягивает электронную плотность на
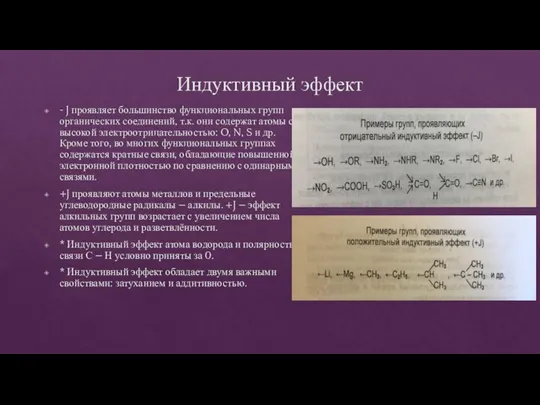
- 12. Индуктивный эффект - J проявляет большинство функциональных групп органических соединений, т.к. они содержат атомы с высокой
- 13. Затухание индуктивного эффекта ИЭ заместителя распространяется на несколько близлежащих атомов углеродной цепи. По цепи сигма-связей ИЭ
- 14. Аддитивность индуктивных эффектов ИЭ аддитивны, т.е. суммируются. Пример. При сравнении кислотности хлоруксусных кислот видно, как с
- 15. Мезомерный эффект. Сопряжённые системы. Типы сопряжения Мезомерные эффекты возникают в сопряжённых системах. Например, в бутадиене –
- 16. Ненаправленный мезомерный эффект в сопряжённых системах без заместителей Выравнивание электронной плотности в бутадиене-1,3 и бензоле представляет
- 17. Отрицательный мезомерный эффект (-М) в π,π-сопряжённых системах с заместителями Если в π,π-сопряжённой системе появляются функциональные группы,
- 18. Положительный мезомерный эффект в р,π-сопряжённых системах Р,π – сопряжение – это такой тип сопряжения, когда кратные
- 19. Химические свойства Бензол в обычных условиях не присоединяет бром и не обесцвечивает бромную воду. Раствор перманганата
- 20. Классификация реакций замещения При замещении в бензольном кольце возможны 3 типа реакций в зависимости от природы
- 21. 3. Электрофильное замещение. Атакующий реагент несёт на атоме, вступающем в связь с углеродным атомом бензольного ядра,
- 22. Реакции замещения 1. Нитрование смесью азотной и серной кислот обычно происходит в результате атаки бензольного кольца
- 23. 2. Галогенирование. Применяют катализаторы – безводные галогены алюминия или железа, вызывающие поляризацию или даже гетеролитическую диссоциацию
- 24. 3. Алкилирование по Фриделю – Крафтсу. Реакцию проводят с помощью галогеналкилов в присутствии хлорида алюминия. Роль
- 25. 4. Ацилирование (введение остатка кислоты RCO - ). В качестве ацилирующих агентов используют галогенангидриды и ангидриды
- 26. Реакционная способность аренов при электрофильном замещении Молекула бензола симметрична, все атомы углерода равноценны, поэтому электрофильная частица
- 27. Закономерности по влиянию заместителей на ориентацию при электрофильном замещении При сопоставлении уже имеющихся заместителей в бензольном
- 28. Пример ИЭ группы NO2 – отрицательный, т.к. здесь есть кратная связь и атом кислорода является электроотрицательным.
- 29. Согласованная ориентация При наличии в бензольном ядре 2-х заместителей их ориентирующее влияние может быть согласованным, когда
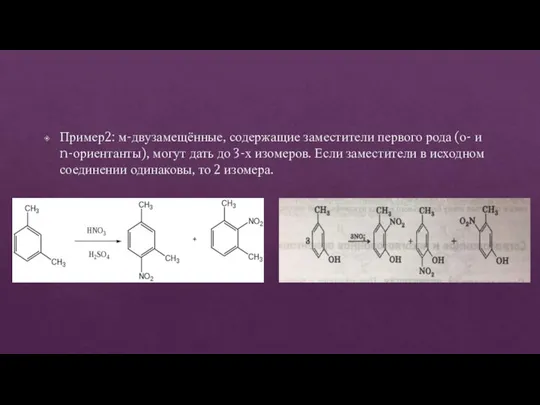
- 30. Пример2: м-двузамещённые, содержащие заместители первого рода (о- и n-ориентанты), могут дать до 3-х изомеров. Если заместители
- 31. Пример3: о-двузамещённые, содержащие заместители различных родов, тоже имеют 2 изомера.
- 32. Несогласованная ориентация Двузамещённые бензолы, в которых один из заместителей направляет новые группы в иные положения, чем
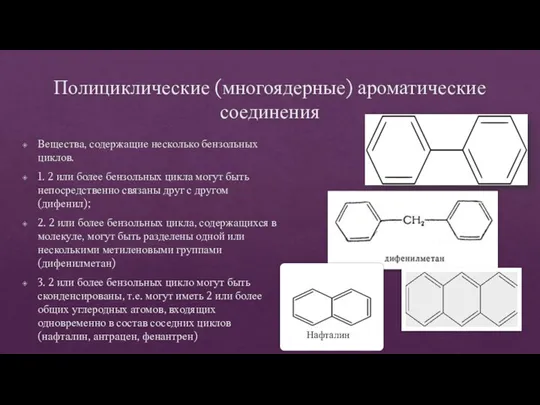
- 33. Полициклические (многоядерные) ароматические соединения Вещества, содержащие несколько бензольных циклов. 1. 2 или более бензольных цикла могут
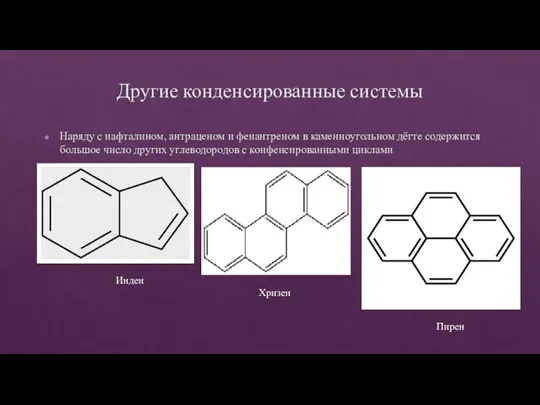
- 34. Другие конденсированные системы Наряду с нафталином, антраценом и фенантреном в каменноугольном дёгте содержится большое число других
- 35. Идентификация аренов Если углеводород является непредельным по составу, но не даёт типичных реакций присоединения, то с
- 36. Галогенопроизводные углеводородов Это органические соединения, образующиеся при замене атомов водорода в углеводородах на атомы галогенов. В
- 37. Изомерия и номенклатура Моногалогенпроизводные предельных углеводородов называются алкилгалогенидами. Общая формула CnH2n+1X, где Х – F, Cl,
- 38. Из пропана, замещая водород на галоген, можно получить 2 изомерных галогенопроизводных: CH3 – CH2 – CH2
- 39. Названия простых 2-хвалентных радикалов, получающихся отнятием 2-х атомов Н от 2-х соседних атомов углерода, обычно производят
- 40. Номенклатура июпак Названия галогенсодержащих соединений производятся от названий углеводородов, впереди ставится название галогена и цифра, обозначающая,
- 41. Методы получения 1. Действие галогенов на предельные углеводороды при облучении светом (реакция металепсии) H3C – CH3
- 42. 2. Получение из спиртов. Самые распространённые способы – действие на спирты галогенидов фосфора или серы и
- 43. Химические свойства Атом любого галогена обладает большим сродством к электрону, чем атом углерода, сигма-связь С –
- 44. 1. Реакция гидролиза А)При действии свежеприготовленного гидроксида серебра и даже воды (особенно в присутствии щелочей) галогеналкилы
- 45. 2. Реакция ß-элиминирования При действии на алкилгалогениды спиртовых растворов щелочей образуются алкены. 3. Реакция Вюрца
- 46. Методы идентификации Присутствие галогена в молекуле органического соединения доказывают пробой на галоген по Бейльштейну или восстановлением
- 48. Скачать презентацию









































 Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Органические вещества
Органические вещества Этапы аналитических работ
Этапы аналитических работ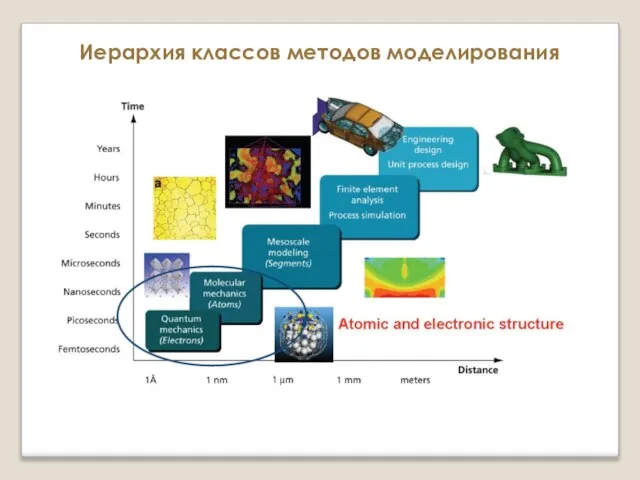 Атомистическое моделирование
Атомистическое моделирование Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия  Ковалентная неполярная связь
Ковалентная неполярная связь Учебное задание Расчет теплоты сгорания
Учебное задание Расчет теплоты сгорания Степень окисления
Степень окисления Klas_kh_r_-ur_-urok1
Klas_kh_r_-ur_-urok1 Соляная кислота и ее свойства
Соляная кислота и ее свойства ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Медь
Медь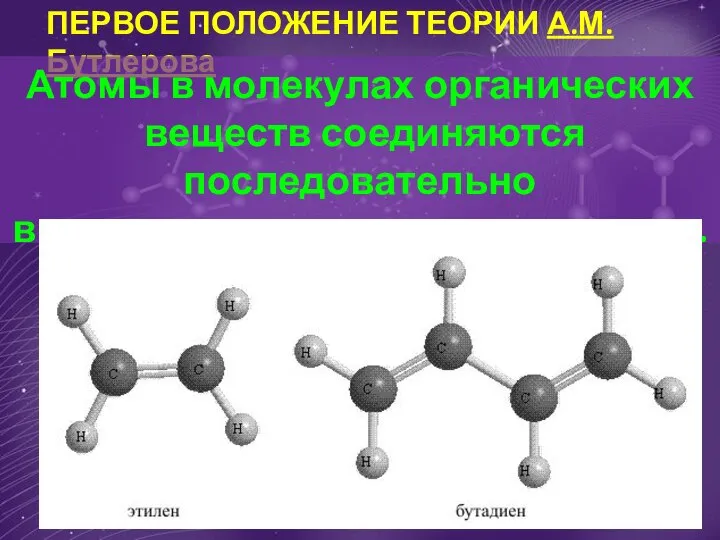 Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно
Первое положение теории А.М. Бутлерова Атомы в молекулах органических веществ соединяются последовательно Силикатная промышленность
Силикатная промышленность Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Презентация на тему История семи великих камней Алмазного фонда России
Презентация на тему История семи великих камней Алмазного фонда России  Титриметрический анализ
Титриметрический анализ Енергетика хімічних реакцій
Енергетика хімічних реакцій Соль - без вины виновата
Соль - без вины виновата Презентация по химии на тему _Закон постоянства со
Презентация по химии на тему _Закон постоянства со Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Презентация на тему Химия вокруг нас
Презентация на тему Химия вокруг нас  Prezentatsia1_1 (1)
Prezentatsia1_1 (1) Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена صيغ المركبات وأسمائها
صيغ المركبات وأسمائها Тест по теме Основные классы неорганических соединений
Тест по теме Основные классы неорганических соединений Опасные химические вещества и их поражающее действие на организм человека
Опасные химические вещества и их поражающее действие на организм человека