Содержание
- 2. Сила сцепленья вяжет пары́, Мощь тяготенья держит миры, Атомов сродство жизнь создает, Света господство к знанью
- 3. Межмолекулярные взаимодействия: Силы И. Ван-дер-Ваальса Водородные связи Комплексные соединения 1.7 ДПМ
- 4. 1. Силы И.Ван-дер-Ваальса (голландский ученый, 1873 г.) – силы межмолекулярного взаимодействия, проявляющиеся на расстояниях, превосходящих размеры
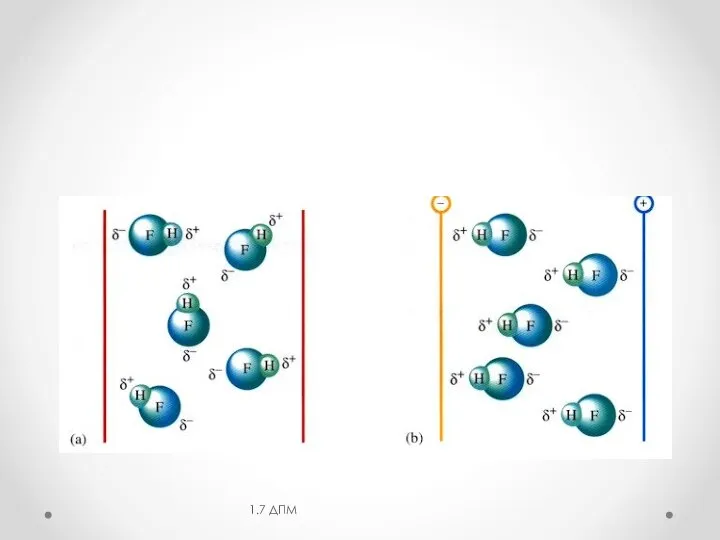
- 5. 1.1 Диполь- дипольное взаимодействие (эффект Кьезома) электростатическое взаимодействие полярных молекул при сближении Еориен увеличивается с увеличением
- 6. 1.2 Индукционная составляющая (эффект Дебая) 1.7 ДПМ -электростатическое взаимодействие полярной и неполярной молекул Диполи, действуя на
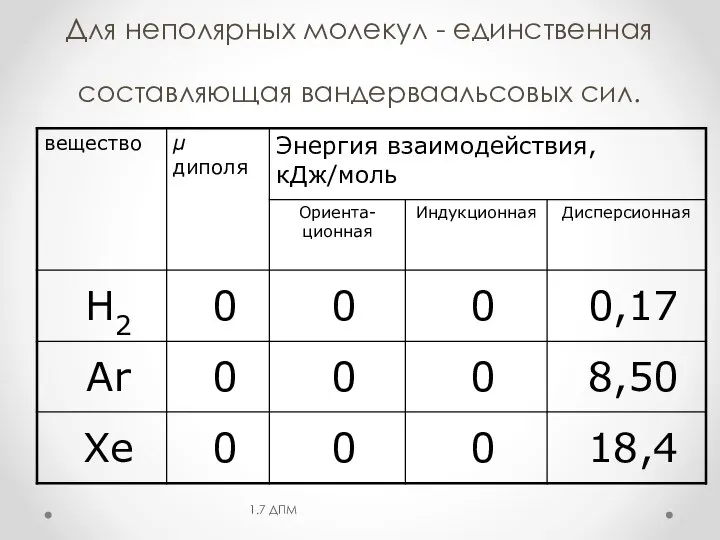
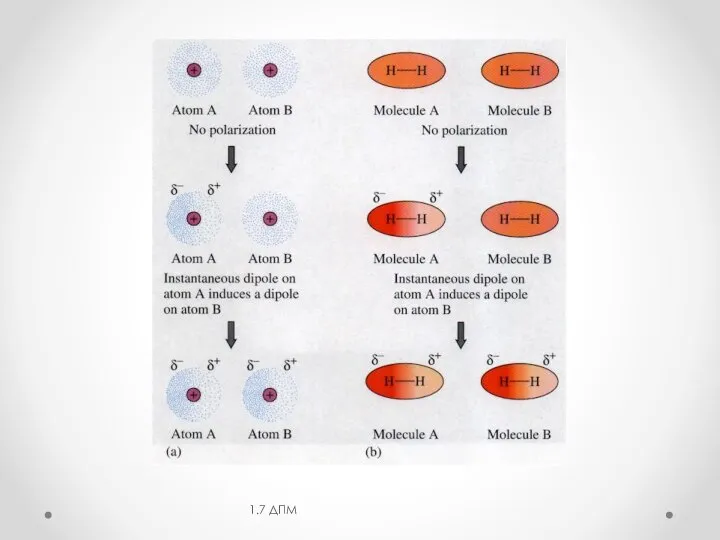
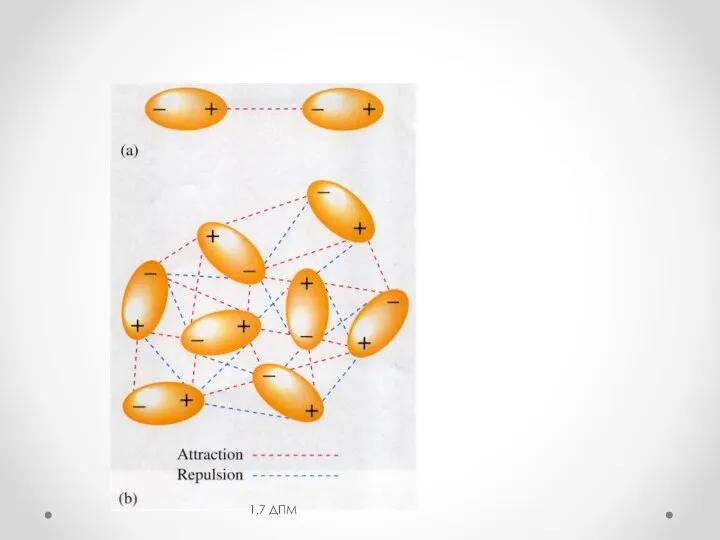
- 7. 1.3 Дисперсионная составляющая (эффект Лондона) 1.7 ДПМ -электростатическое взаимодействие мгновенных диполей, возникающих за счет флуктуации электрической
- 8. Для неполярных молекул - единственная составляющая вандерваальсовых сил. 1.7 ДПМ
- 9. 1.7 ДПМ
- 10. 1.7 ДПМ
- 11. 1.7 ДПМ
- 12. 1.7 ДПМ
- 13. 2. Водородная связь — связывание между атомом водорода одной молекулы, соединённого ковалентной связью с электроотрицательным атомом
- 14. Природа водородной связи промежуточная между ковалентной, ионной и диполь-дипольной. Энергия водородной связи — промежуточная между значениями,
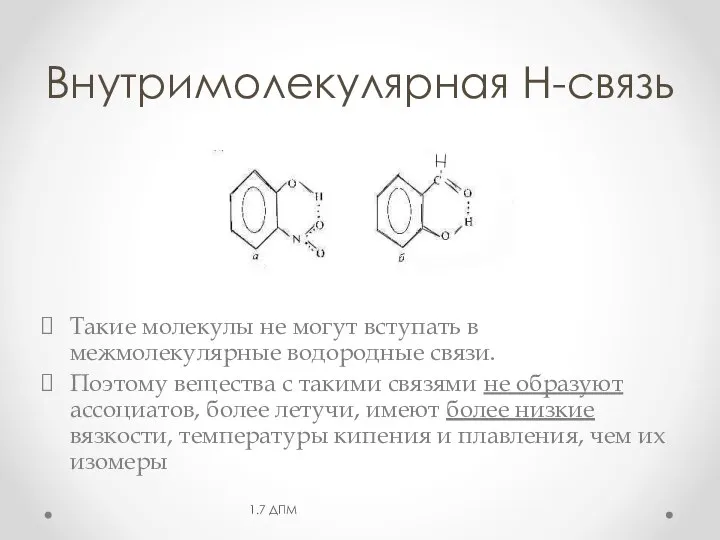
- 15. Внутримолекулярная Н-связь Такие молекулы не могут вступать в межмолекулярные водородные связи. Поэтому вещества с такими связями
- 16. Межмолекулярная Н-связь А – Н + В – R → А – Н⋅⋅⋅В – R водород
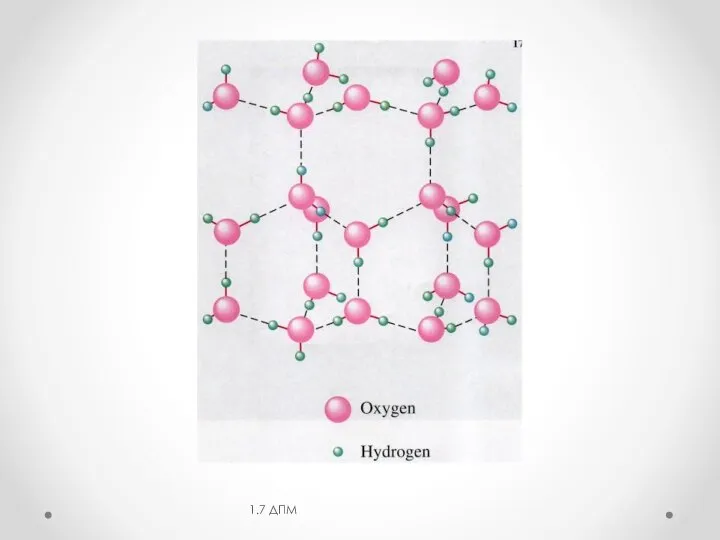
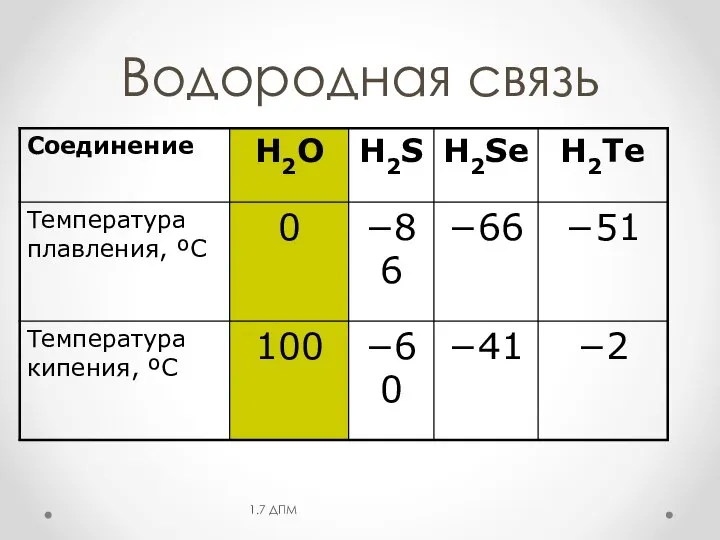
- 17. Межмолекулярные Н-связи изменяют свойства веществ: повышают вязкость, диэлектрическую постоянную, температуру кипения и плавления, теплоту плавления и
- 18. Водородная связь 1.7 ДПМ
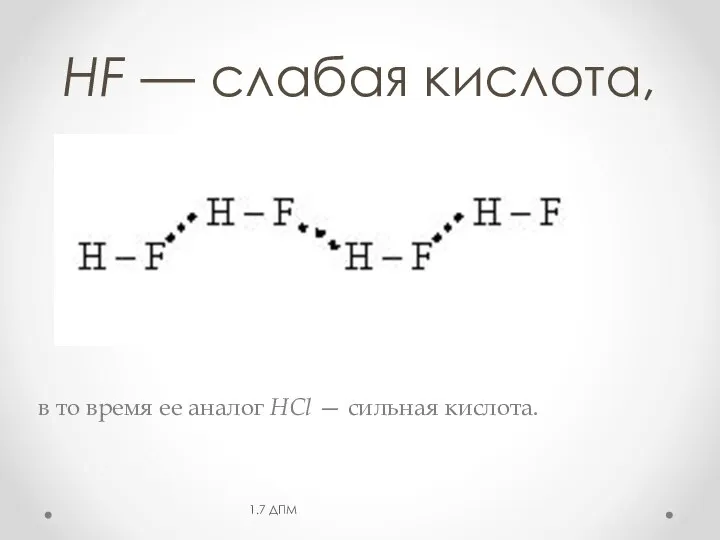
- 19. HF — слабая кислота, в то время ее аналог НСl — сильная кислота. 1.7 ДПМ
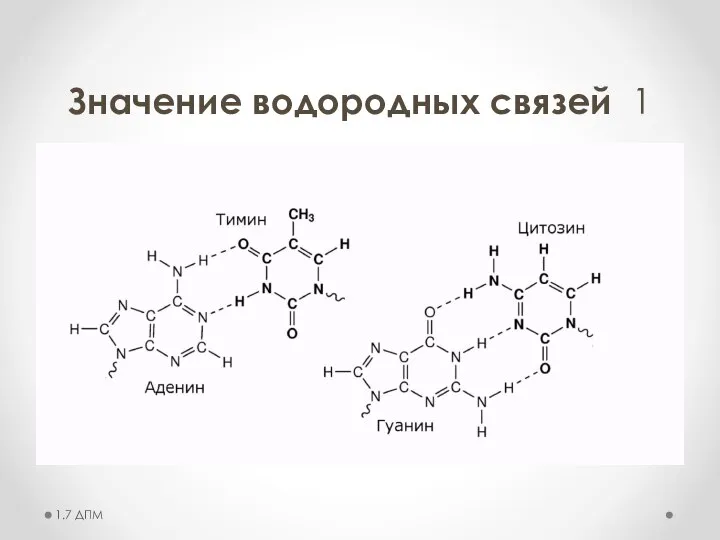
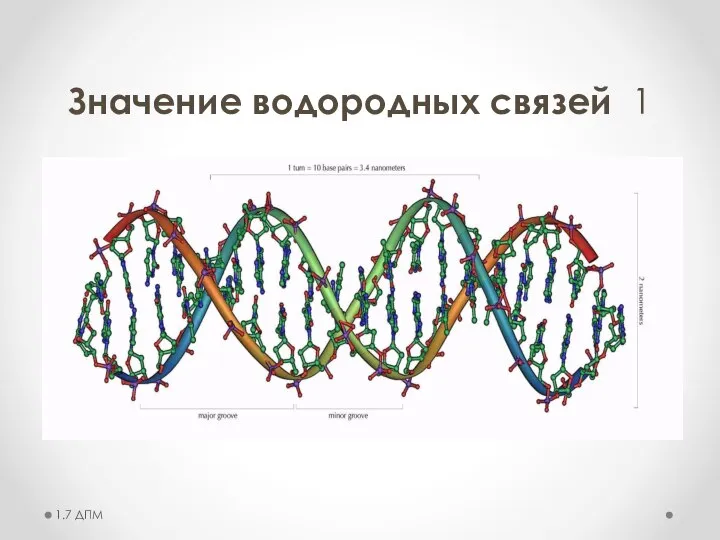
- 20. Значение водородных связей 1 1.7 ДПМ
- 21. Значение водородных связей 1 1.7 ДПМ
- 22. 3. Комплексные соединения (координационные соединения) —сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму.
- 23. Строение комплексной соли K4[Fe(CN)6] Fe2+ комплексообразователь CN- лиганд 6 координационное число K+ внешняя сфера Гексацианоферрат (II)
- 25. Скачать презентацию











![Строение комплексной соли K4[Fe(CN)6] Fe2+ комплексообразователь CN- лиганд 6 координационное число K+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1138453/slide-22.jpg)
 Дисперсные системы
Дисперсные системы Долговечность пластмасс
Долговечность пластмасс Деформация аморфных и кристаллических полимеров
Деформация аморфных и кристаллических полимеров Презентация на тему Роль химии в жизни человека
Презентация на тему Роль химии в жизни человека  Физические величины для подсчета числа частиц вещества
Физические величины для подсчета числа частиц вещества Полиметилсилсесквиоксаны. Современное состояние исследований
Полиметилсилсесквиоксаны. Современное состояние исследований Воздействие слюны на крахмал
Воздействие слюны на крахмал Фуллерены: аллотропы углерода
Фуллерены: аллотропы углерода Оксосоединения. Альдегиды и кетоны
Оксосоединения. Альдегиды и кетоны Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач
Подготовка к олимпиаде по химии. Некоторые идеи составления и решения нестандартны задач Кислоты и их свойства
Кислоты и их свойства Карбоцепные полимеры
Карбоцепные полимеры Общие способы получения металлов
Общие способы получения металлов Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи
Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи Мыльная история
Мыльная история Клей
Клей Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей
Химическая связь. Описание ковалентной химической связи методом молекулярных орбиталей allotropiya_fosfora_him._svoystva
allotropiya_fosfora_him._svoystva Замедленное коксование гудрона
Замедленное коксование гудрона Платина
Платина Строение атома
Строение атома Правила заполнения орбиталей электронами
Правила заполнения орбиталей электронами Карбоновые кислоты
Карбоновые кислоты Кремний
Кремний Металлы. Контрольная работа
Металлы. Контрольная работа Мышьяк
Мышьяк Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс)