Содержание
- 2. Степень окисления. Под степенью окисления понимается условный заряд атома в соединении, вычисленный, исходя из предположения, что
- 3. Большинство элементов могут проявлять переменную С.О. в соединениях. В качестве примера рассчитаем С.О. серы в соединениях
- 4. Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление — это процесс отдачи электронов веществом,
- 5. Восстановление — это процесс присоединения электронов веществом, в результате чего степени окисления понижается: Cu2+ + 2e
- 6. Атом того или иного элемента в своей высшей степени окисления может только понизить ее, т.е. в
- 8. Высшую степень окисления элемента, как правило, определяет номер группы периодической системы Д.И. Менделеева, в которой он
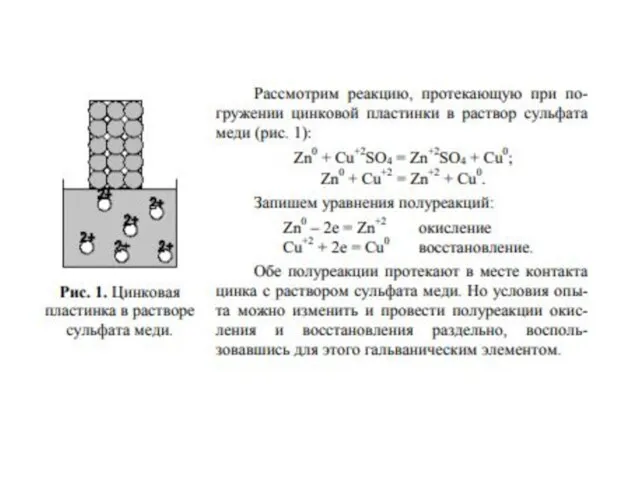
- 9. Реакции, в которых окислители и восстановители представляют собой различные вещества, называются межмолекулярными: Zn0 + Cu+2SO4 =
- 10. В окислительно-восстановительных реакциях наряду с окислителями и восстановителями могут участвовать ионы или молекулы среды. Например, в
- 45. Скачать презентацию



































 Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Химические реакции
Химические реакции Стекло. Определение стекла
Стекло. Определение стекла Определение Кофеина в Кофе
Определение Кофеина в Кофе Номенклатура органических соединений
Номенклатура органических соединений Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Получение метанола из синтез-газа
Получение метанола из синтез-газа Основания и их свойства
Основания и их свойства Аминокислоты и их применение
Аминокислоты и их применение Диаграмма состояния BaO-Al2O3-SiO2
Диаграмма состояния BaO-Al2O3-SiO2 Органическая химия
Органическая химия Дисперсные системы
Дисперсные системы Презентация на тему Щелочные и щелочноземельные металлы
Презентация на тему Щелочные и щелочноземельные металлы 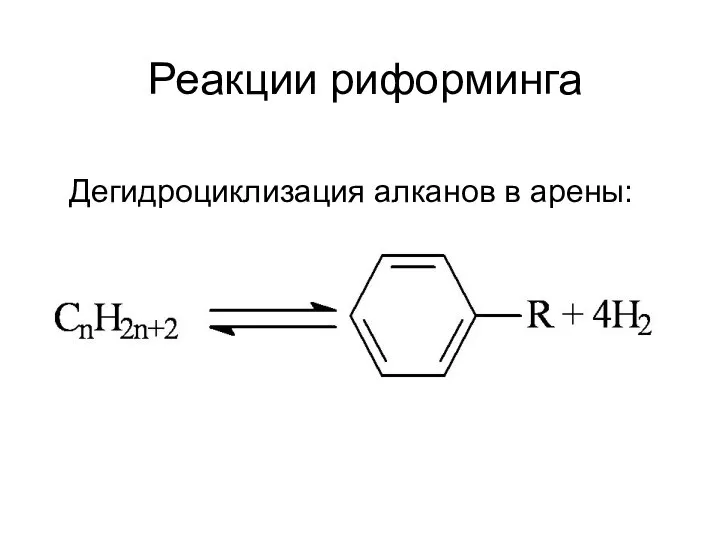 Реакции риформинга
Реакции риформинга Glin
Glin Таблица Менделеева
Таблица Менделеева Сода: мифы и реальность
Сода: мифы и реальность Биологическое окисление
Биологическое окисление Презентация на тему Алкины
Презентация на тему Алкины  Первоначальные химические понятия
Первоначальные химические понятия Щелочноземельные металлы
Щелочноземельные металлы Розчинність речовин, її залежність від різних чинників
Розчинність речовин, її залежність від різних чинників Фенолы
Фенолы Арены. Бензол
Арены. Бензол Произведение растворимости
Произведение растворимости ОГЭ химия. Основной государственный экзамен
ОГЭ химия. Основной государственный экзамен Основания. Состав оснований
Основания. Состав оснований Природный каучук
Природный каучук