Содержание
- 2. Открытие азота 12 сентября 1772 года — Даниель Резерфорд 1771 - 1773 гг. — Г. Кавендиш
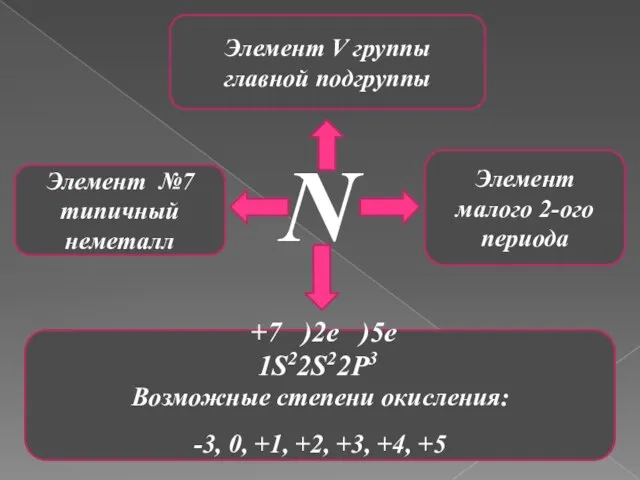
- 3. N Элемент V группы главной подгруппы Элемент №7 типичный неметалл Элемент малого 2-ого периода +7 )2e
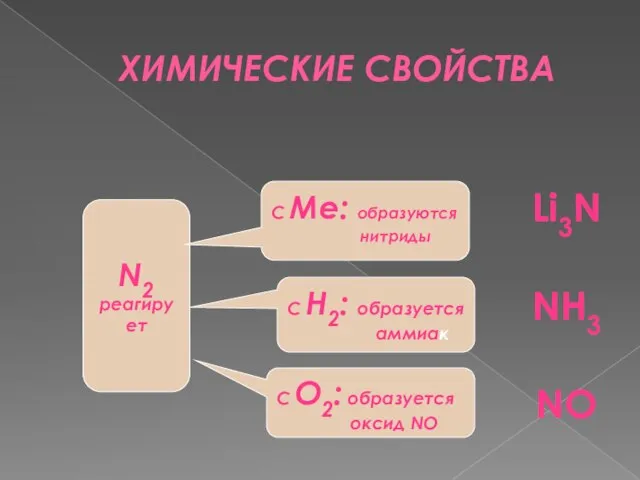
- 4. ХИМИЧЕСКИЕ СВОЙСТВА N2 реагирует С Ме: образуются нитриды С Н2: образуется аммиак С О2: образуется оксид
- 5. ФИЗИЧЕСКИЕ СВОЙСТВА N2 Газ без вкуса, цвета, запаха. Плохо растворим в воде. Легче воздуха.
- 6. Азот присутствует во всех живых организмах (1-3% на сухую массу), являясь важнейшим биогенным элементом. Он входит
- 7. Нахождение в природе По распространенности в земной коре азот занимает 17-е место, на его долю приходится
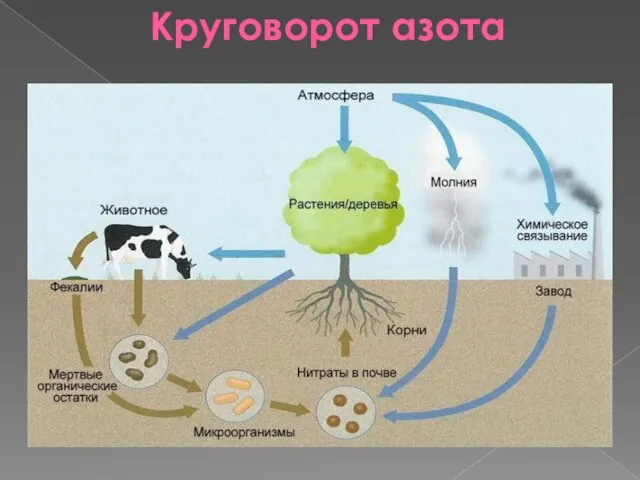
- 8. Круговорот азота
- 9. Поставщик связанного азота в природе Главный поставщик связанного азота в природе — бактерии: благодаря им связывается
- 10. Некоторое количество азота переводится в связанное состояние во время грозы Электрический разряд нагревает атмосферу вокруг себя,
- 11. Получение азота в промышленности: фракционная перегонка жидкого воздуха ОАО «Невинномысский Азот" Завод по производству азота из
- 12. Получение азота в лаборатории (разложением солей аммония) 1. Разложением нитрита аммония NH4NO2=N2 + 2H2O 2. Разложением
- 13. N2 Жидкий азот в медицине Синтез аммиака Производство удобрений Синтез азотной кислоты Создание инертной среды
- 14. В косметологии Для создания инертной среды при опытах Как хладагент Для синтеза аммиака Применение N 2
- 15. Применение соединений азота производство минеральных удобрений производство взрывчатых веществ производство лекарственных препаратов
- 17. Скачать презентацию











 Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Электролитическая диссоциация
Электролитическая диссоциация Химия в системе современных естественнонаучных представлений
Химия в системе современных естественнонаучных представлений Презентация по Химии "Получение уксусной кислоты и опыты с ней"
Презентация по Химии "Получение уксусной кислоты и опыты с ней"  Спирты и фенолы
Спирты и фенолы Криптон. Самостоятельная работа
Криптон. Самостоятельная работа Кинетическое лимитирование роста и жизненные стратегии микроорганизмов
Кинетическое лимитирование роста и жизненные стратегии микроорганизмов Кремень – камень
Кремень – камень Ароматерапия
Ароматерапия nukleinovye_kisloty
nukleinovye_kisloty Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Изомерия и ее виды
Изомерия и ее виды Соединения щелочных металлов
Соединения щелочных металлов Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню
Участь антиоксидантної системи saccharomyces cerevisiae у горметичному ефекті пероксиду водню Диссоциация кислот, щелочей солей
Диссоциация кислот, щелочей солей 4.1-2 Генетическая связь+
4.1-2 Генетическая связь+ Аммиак. Строение молекулы. Водородная связь
Аммиак. Строение молекулы. Водородная связь Биоорганическая химия
Биоорганическая химия Дисперсные системы. Гели
Дисперсные системы. Гели Алкены-3
Алкены-3 Природні сполуки алюмінію і методи одержання
Природні сполуки алюмінію і методи одержання Двовимірний ямр. Основні принципи
Двовимірний ямр. Основні принципи Простые вещества металлы
Простые вещества металлы Качественное определение углерода, водорода и хлора в органических соединениях
Качественное определение углерода, водорода и хлора в органических соединениях Водород
Водород Знатоки химии. Химия первопричина всех причин
Знатоки химии. Химия первопричина всех причин Калий. Общая информация
Калий. Общая информация Альдегиды
Альдегиды