Слайд 2Водород как элемент открыл Г.Кавендиш в 1766 и назвал его «горючим воздухом»,

а в 1781 он доказал, что вода – это продукт его взаимодействия с кислородом. Латинское название hydrogenium, которое происходит от греческого сочетания «рождающий воду», было присвоено этому элементу А.Лавуазье.
Слайд 3Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости

элемент.
Водород — самый распространённый эле-мент во Вселенной. Он — основная составная часть звезд и межзвездного газа.
Три изотопа водорода имеют собственные названия: 1H — протий (Н), 2H — дейтерий (D) и 3H — тритий (T).
Слайд 4
Строение атома водорода:
заряд ядра +1
число протонов 1
число электронов 1
1s1
валентность =1
степень окисления +1
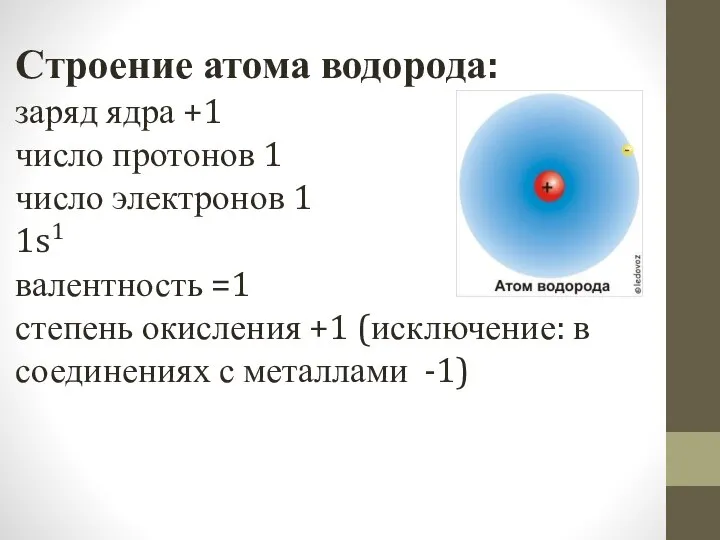
(исключение: в соединениях с металлами -1)
Слайд 5Водород – простое вещество.
Молекула водорода Н2
Водород — самый лёгкий газ, он легче
воздуха в

14,5 раз (Мr (воздуха) = 29),
без цвета, запаха и вкуса.
Плотность 0,08987 г/л (н.у.),
Температура кипения −252,76 °C,
малорастворим в воде — 18,8 мл/л.
Слайд 6С воздухом образует взрывоопасную смесь - гремучий газ.
Наибольшую взрывоопасность этот газ

имеет при объёмном отношении водорода и кисло-рода 2:1, или водорода и воздуха приближён-но 2:5.
Также водород пожароопасен.
Жидкий водород при попадании на кожу мо-жет вызвать сильное обморожение.
Слайд 7Получение водорода
В лаборатории:
действие разбавленных кислот на металлы.
Zn + 2HCl → ZnCl2+

H2↑
2. В промышленности:
Электролиз водных растворов солей:
2NaCl+ 2H2O→ H2↑ + 2NaOH+ Cl2
Слайд 8Химические свойства
Взаимодействие с простыми веществами. При обычных температурах водород реагирует только со

щелочными щелочно-земельными металлами, образуя гидриды:
Ca + Н2 = СаН2 (гидрид кальция)
2Na + H2 = 2NaH (гидрид натрия)
(Гидриды— солеобразные, твёрдые вещества, легко разлагаются водой:
CaH2+ 2H2O→ Ca(OH)2+ 2H2↑ )
и с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
реакция протекает со взрывом
Слайд 9С большинством же металлов и неметаллов водород реагирует при повышенной температуре:
О2 +

2Н2 = 2Н2О
N2 + 3H2 → 2NH3 (аммиак)
С галогенами образует галогеноводороды:
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
Слайд 102. Взаимодействие со сложными веществами.
Взаимодействие с оксидами металлов (как правило, d-элементов).
Оксиды восстанавливаются

до металлов:
CuO + H2 → Cu + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
Слайд 11
Применение водорода
1. Атомарный водород используется для атомно-водородной сварки.
2. При производстве аммиака, метанола,

мыла и пластмасс.
3. При производстве маргарина из жидких растительных масел. Зарегистрирован в качестве пищевой добавки E949.
Слайд 124. Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли

и воздушные шары наполняли водоро-дом. Но в 30-х гг. XX в. произошло нес-колько катастроф, в ходе которых дири-жабли взрывались и сгорали. В наше вре-мя дирижабли наполняют гелием, несмотря на его существенно более высокую стоимость.











 Презентация по Химии "Фиолетовый проказник"
Презентация по Химии "Фиолетовый проказник"  Окислительно – восстановительные реакции (урок химии в 11 классе)
Окислительно – восстановительные реакции (урок химии в 11 классе) Экзаменационные билеты
Экзаменационные билеты Периодический закон и строение атома
Периодический закон и строение атома Алкены
Алкены Азот, соединения азота
Азот, соединения азота Препараты гормонов стероидной структуры
Препараты гормонов стероидной структуры Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Основы химической термодинамики
Основы химической термодинамики Классы неорганических соединений
Классы неорганических соединений Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли
Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли  Составление формул по валентности. Понятие
Составление формул по валентности. Понятие Синтез органічних сполук різних класів на основі вуглеводневої сировини
Синтез органічних сполук різних класів на основі вуглеводневої сировини Химия. Соотечественники, внёсшие большой вклад в становление и развитие этой науки
Химия. Соотечественники, внёсшие большой вклад в становление и развитие этой науки Щелочные металлы
Щелочные металлы Явление когда один элемент образует несколько простых веществ - аллотропия
Явление когда один элемент образует несколько простых веществ - аллотропия Гималайская соль
Гималайская соль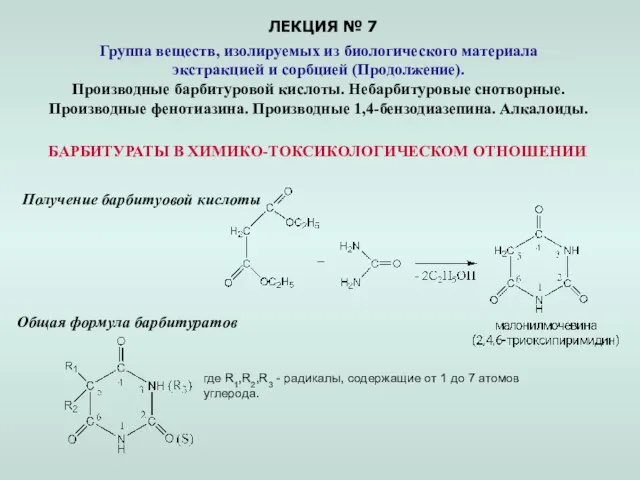 Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"
Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"  Модель Томпсона. Модель Резерфорда
Модель Томпсона. Модель Резерфорда Электролиз
Электролиз Кислород. Нахождение в природе. Свойства. 8 класс
Кислород. Нахождение в природе. Свойства. 8 класс Метод проекта на уроках химии и биологии и внеурочное время
Метод проекта на уроках химии и биологии и внеурочное время Оксиды. Сложные вещества
Оксиды. Сложные вещества Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Аспирин и его влияние на организм человека
Аспирин и его влияние на организм человека Биосинтез кортикостероидов из ацетил КоА и ХС
Биосинтез кортикостероидов из ацетил КоА и ХС Дисперсные системы
Дисперсные системы Презентация на тему Знаки химических элементов
Презентация на тему Знаки химических элементов