Содержание
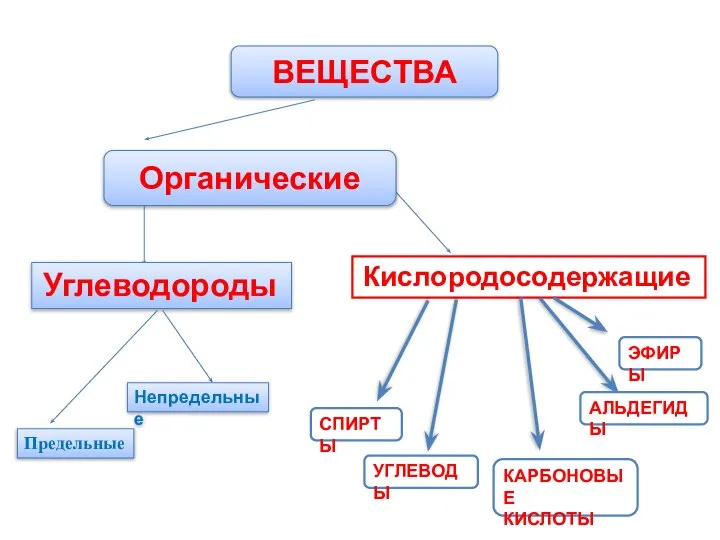
- 2. ВЕЩЕСТВА Органические Углеводороды Кислородосодержащие Предельные Непредельные СПИРТЫ УГЛЕВОДЫ КАРБОНОВЫЕ КИСЛОТЫ АЛЬДЕГИДЫ ЭФИРЫ
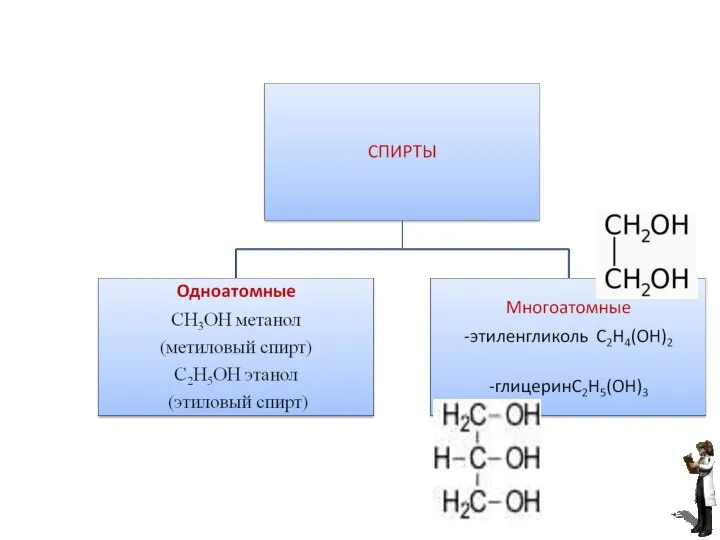
- 3. СПИРТЫ - это органические вещества, в которых гидроксильная группа связана с углеводородным радикалом. Соответствующие общей формуле
- 4. СН3ОН метанол (метиловый спирт) С2Н5ОН этанол (этиловый спирт) количество гидроксильных групп глицерин Этиленгликоль(антифриз)
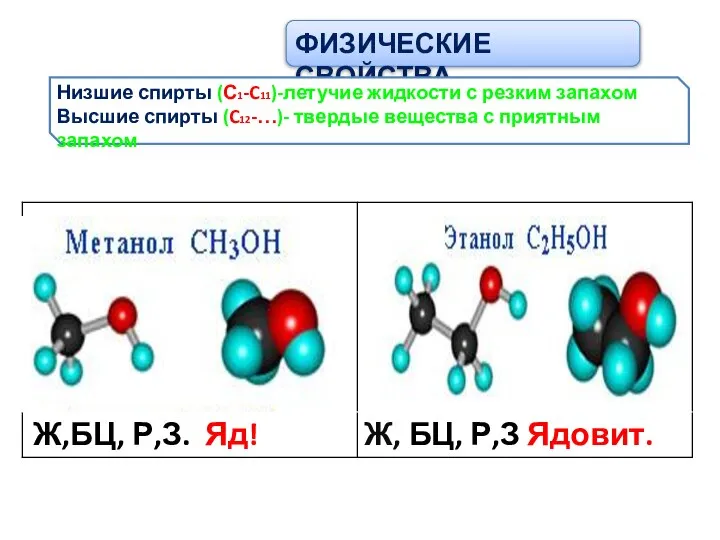
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА Низшие спирты (С1-C11)-летучие жидкости с резким запахом Высшие спирты (C12-…)- твердые вещества с приятным
- 8. ФИЗИЧЕСКИЕ СВОЙСТВА Низшие спирты (С1-C11)-летучие жидкости с резким запахом Высшие спирты (C12-…)- твердые вещества с приятным
- 9. Применение
- 10. Получение этанола 1. Гидратация этилена: СН2 = СН2 + Н2О → С2Н5ОН этилен этанол 2. Брожение
- 11. Химические свойства спиртов 1. Горение 2СН3ОН + 3О2→ 2СО2 + 4Н2О метанол Горит бесцветным пламенем. С2Н5ОН
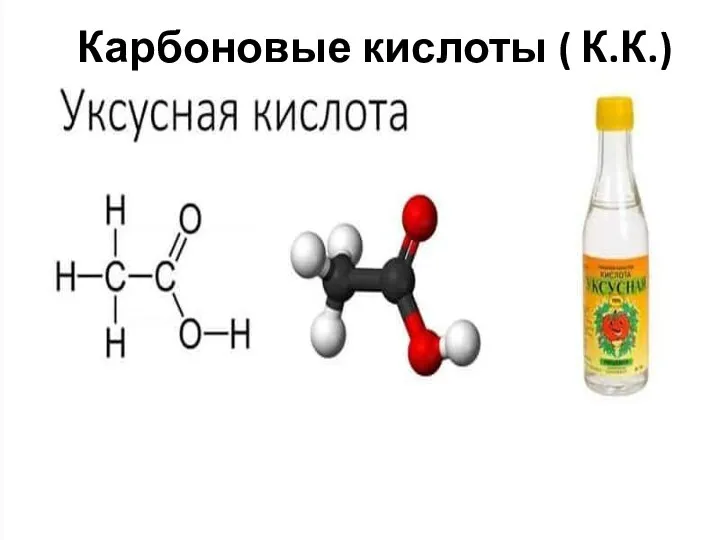
- 12. Карбоновые кислоты ( К.К.)
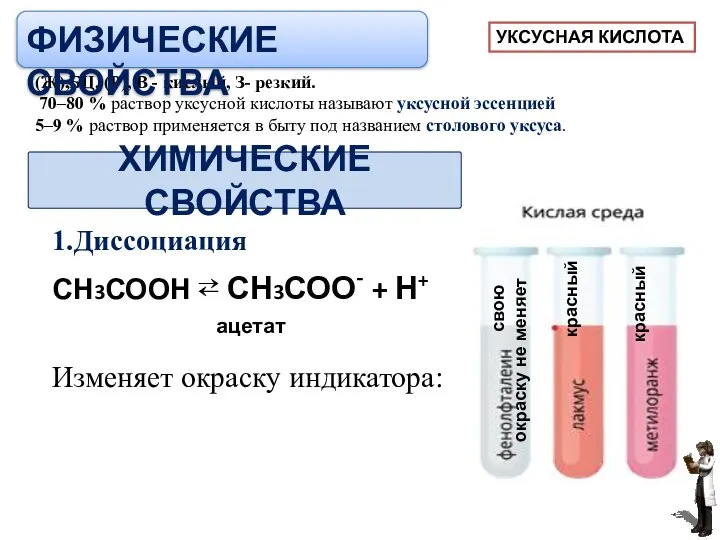
- 13. ХИМИЧЕСКИЕ СВОЙСТВА 1.Диссоциация СН3СООН ⇄ СН3СОО- + Н+ ацетат Изменяет окраску индикатора: свою окраску не меняет
- 14. Х.С. 2. Взаимодействует с металлами: 2СН3СООН + Мg → (CH3COO)2Mg + H2 ацетат магния 3. Взаимодействует
- 16. Скачать презентацию








 Металлы
Металлы Предельные одноатомные спирты
Предельные одноатомные спирты Ocena zawartości mikotoksyn w wybranych produktach spożywczych
Ocena zawartości mikotoksyn w wybranych produktach spożywczych анлекция 3
анлекция 3 10 класс Алкадиены более совершенная (2)
10 класс Алкадиены более совершенная (2) Шаблон презентации по химии
Шаблон презентации по химии Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Ионные уравнения
Ионные уравнения Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов
Расчет равновесного состояния системы натрий-кислород-водород, для энергетических ядерных реакторов Химическое кафе «Кислоты»
Химическое кафе «Кислоты» Рубидий (лат. Rubidium)
Рубидий (лат. Rubidium) Алкины
Алкины Алкадиены
Алкадиены Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"
Презентация по Химии "Введение в органическую химию в тезисах, аргументах и фактах"  Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Разминка для болельщиков
Разминка для болельщиков Решение задач. Подготовка к контрольной работе по химии
Решение задач. Подготовка к контрольной работе по химии Основные виды сырья для промышленности органического и нефтехимического синтеза
Основные виды сырья для промышленности органического и нефтехимического синтеза Применение ЦОР на уроках биологии и химии
Применение ЦОР на уроках биологии и химии Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Химия и жизнь
Химия и жизнь ВКР: Определение показателей качества мясной и колбасной продукции различных производителей
ВКР: Определение показателей качества мясной и колбасной продукции различных производителей Массовая доля элемента в веществе
Массовая доля элемента в веществе Гидролиз солей
Гидролиз солей Роль нитрадов. Взгляд специалистов
Роль нитрадов. Взгляд специалистов Материаловедение. Легированные стали и сплавы. (Тема 11)
Материаловедение. Легированные стали и сплавы. (Тема 11)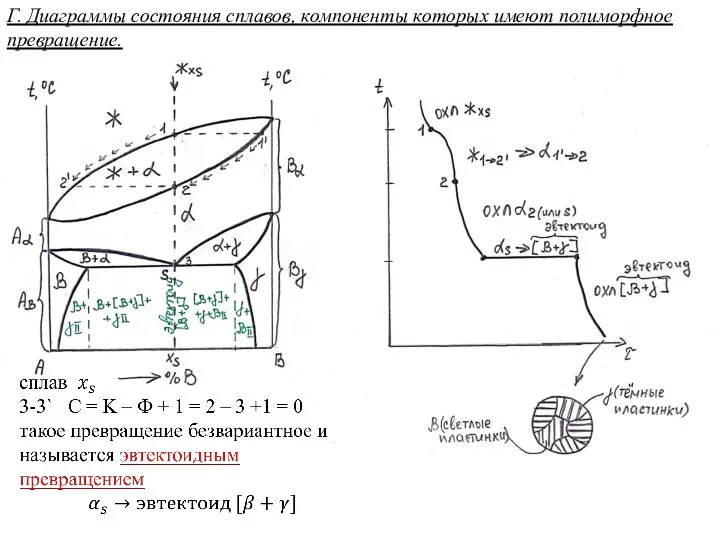 Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение
Диаграммы состояния сплавов, компоненты которых имеют полиморфное превращение