Содержание
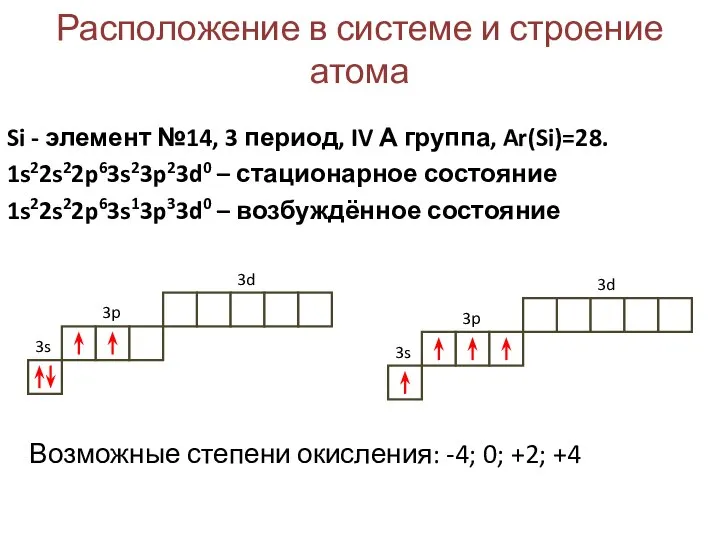
- 2. Расположение в системе и строение атома Si - элемент №14, 3 период, IV А группа, Ar(Si)=28.
- 3. В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фторид кремния SiF4 получил
- 4. Отделочные камни Яшма Агат
- 5. Физические свойства Кристаллический кремний Тёмно-серого цвета, имеет металлический блеск, полупроводниковые свойства Химически инертен. Плотность 2,33 г/см3
- 6. Химические свойства Si + 2F2 → SiF4 (фторид кремния) Si + 2Cl2 → SiCl4 (хлорид кремния)
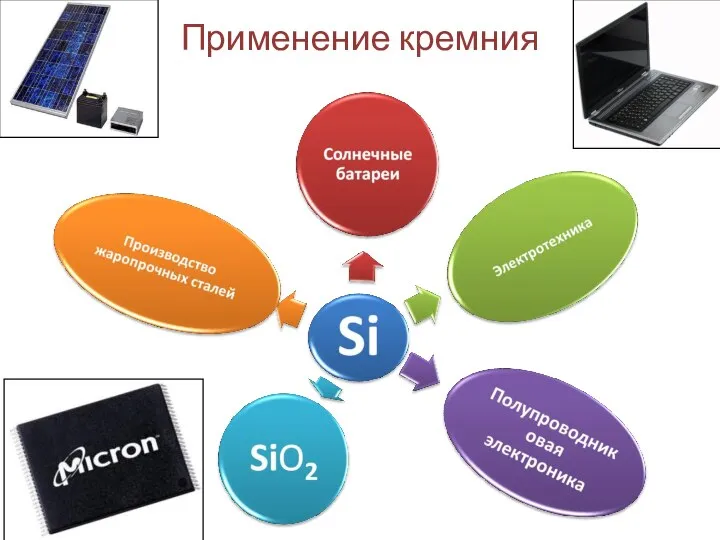
- 7. Применение кремния
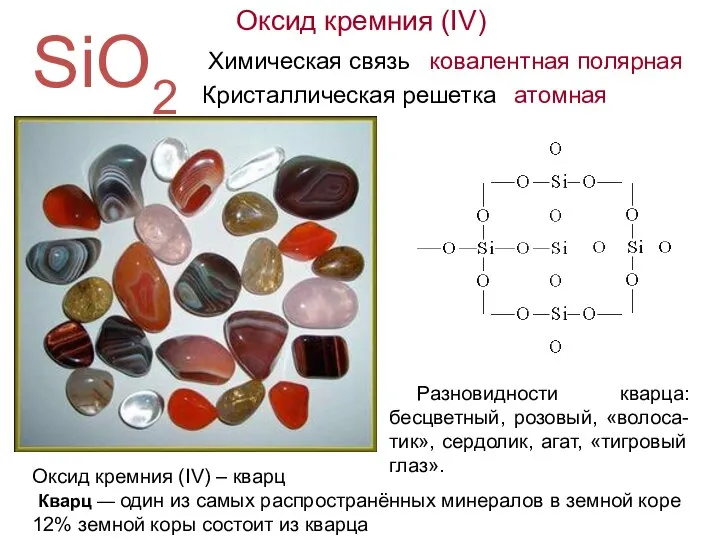
- 8. Оксид кремния (IV) SiO2 Химическая связь ковалентная полярная Кристаллическая решетка атомная Оксид кремния (IV) – кварц
- 9. Химические свойства оксида кремния (IV) Оксид кремния (IV) является оксидом: кислотным Оксид кремния (IV), как типичный
- 10. Применение оксида кремния (IV) Оксид кремния (IV) применяют: для получения кремния как наполнитель в производстве резин
- 11. стекло керамика абразивы
- 12. Ультрозвуковые установки Радиотехника Зажигалки
- 13. Е551 Зубная паста
- 14. Кремниевая кислота. Силикаты nSiO2 ∙ mH2O поликремниевые кислоты N = 1, m = 1 SiO2 ∙
- 15. Лабораторный опыт Испытание раствора силиката натрия индикатором Добавьте к выданному раствору силиката натрия одну каплю фенол-фталиина.
- 16. Силикатная промышленность Соединения кремния служат основой для производства керамики, стекла, цемента, фарфора, силикатного кирпича, т.е. всех
- 17. Керамика Керамика (др.-греч.κέραμος — глина) — изделия из неорганических, неметаллических материалов (например, глины) и их смесей
- 18. Фарфо́р (тур. farfur, fagfur, от перс. фегфур) — вид керамики, непроницаемый для воды и газа. В
- 19. Фаянс (фр. faience, от названия итальянского города Фаэнца, где производился фаянс), керамические изделия (облицовочные плитки, архитектурные
- 20. Майолика (от итал. Maiolica — Мальорка) — разновидность керамики, изготавливаемой из обожжённой глины с использованием расписной
- 22. Скачать презентацию















 Типы химических реакций
Типы химических реакций Вода и ее свойства
Вода и ее свойства Железо и его соединения
Железо и его соединения Гордость земли Большемурашкинской: Владимир Васильевич Марковников
Гордость земли Большемурашкинской: Владимир Васильевич Марковников Классификация химических реакций
Классификация химических реакций Водородная химическая связь
Водородная химическая связь Характеристика щелочных металлов (9 класс)
Характеристика щелочных металлов (9 класс) Воздействие слюны на крахмал
Воздействие слюны на крахмал Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Теория электролитической диссоциации
Теория электролитической диссоциации Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты 1_
1_ Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Предельные углеводороды (циклоалканы)
Предельные углеводороды (циклоалканы) Соли: получение
Соли: получение Презентация на тему Строение атома Химическая связь
Презентация на тему Строение атома Химическая связь  Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Органическая химия. Получение альдегидов и кетонов
Органическая химия. Получение альдегидов и кетонов Характеристика элемента по положению в таблице Д.И.Менделеева
Характеристика элемента по положению в таблице Д.И.Менделеева Оксиды
Оксиды 1.2. Измерения веществ
1.2. Измерения веществ Алканы (строение и изомерия)
Алканы (строение и изомерия) Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Презентация на тему ОВР в органической химии
Презентация на тему ОВР в органической химии  Практика по химии
Практика по химии Химия и производство
Химия и производство Азотная кислота
Азотная кислота Слюда. История открытия
Слюда. История открытия