Содержание
- 4. Напишите уравнения реакций между: а) калием и хлором, б) натрием и йодом, в) литием и водой.
- 5. 1. Оксиды щелочных металлов а) физические свойства: б) химические свойства:
- 6. Составьте уравнения реакций оксида калия с водой, оксида натрия с оксидом фосфора(V) К2O + H2O =
- 7. 2. Гидроксиды щелочных металлов а) физические свойства: б) химические свойства: 1) С кислотами: NaOH + HCl
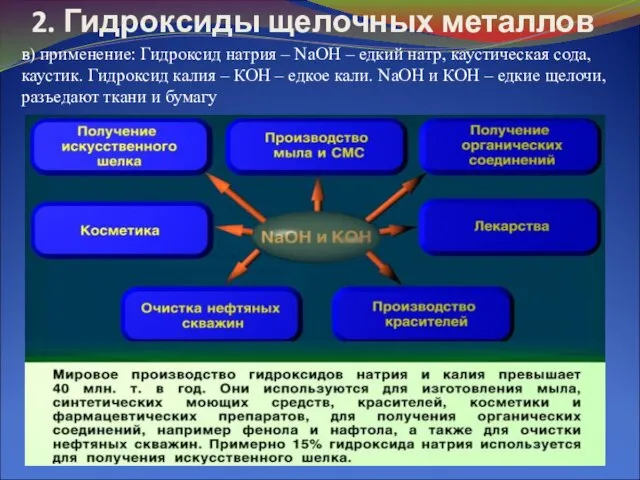
- 8. 2. Гидроксиды щелочных металлов в) применение: Гидроксид натрия – NaOH – едкий натр, каустическая сода, каустик.
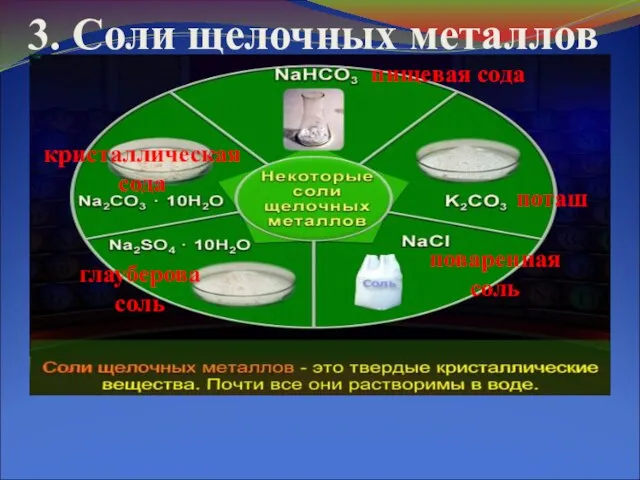
- 9. 3. Соли щелочных металлов пищевая сода поташ поваренная соль глауберова соль кристаллическая сода
- 10. 4. Значение соединений щелочных металлов в жизнедеятельности организмов Ионы натрия и калия играют большую биологическую роль:
- 11. Задание 1 Взрослый человек должен в сутки потреблять с пищей 3,5г ионов калия. Задача. В 100г
- 13. Скачать презентацию







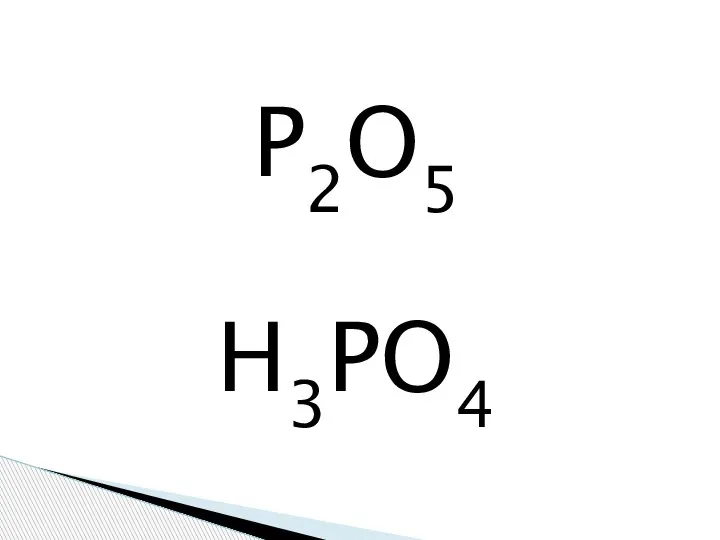 Фосфорная кислота
Фосфорная кислота Все свойства минералов
Все свойства минералов Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить Решение задач
Решение задач Системно-деятельностный подход в обучении химии
Системно-деятельностный подход в обучении химии Валентность и АМУ
Валентность и АМУ Углеводы. Глюкоза. 10 класс
Углеводы. Глюкоза. 10 класс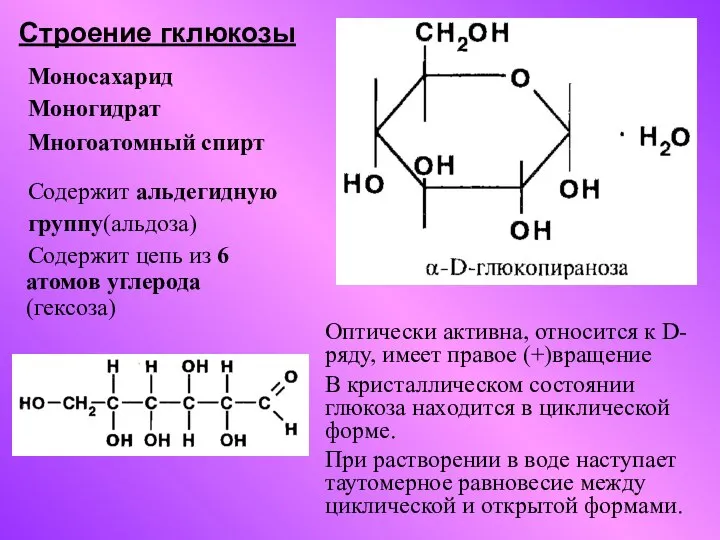 Строение гклюкозы
Строение гклюкозы Структура периодической таблицы
Структура периодической таблицы Минеральные ресурсы
Минеральные ресурсы Минералы. Определения, понятия
Минералы. Определения, понятия Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.
Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А. Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения 10_KISLOTNO_OSNOVNOE_TITROVANIE
10_KISLOTNO_OSNOVNOE_TITROVANIE Спирты. Классификация спиртов
Спирты. Классификация спиртов Первоначальные химические понятия
Первоначальные химические понятия Получение меди
Получение меди Неметаллы. Общая характеристика
Неметаллы. Общая характеристика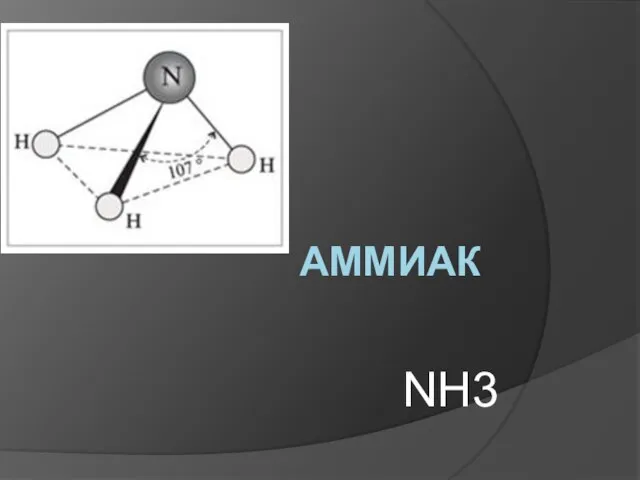 Аммиак NH3
Аммиак NH3 Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства
Двойные латуни. Диаграмма состояния. Примеси. Структура и свойства Электролиз. Задания
Электролиз. Задания Щелочноземельные металлы
Щелочноземельные металлы Специальная обработка, химическая и радиационная обстановка
Специальная обработка, химическая и радиационная обстановка Строение вещества
Строение вещества Природные источники углеводородов
Природные источники углеводородов Подгруппа углерода
Подгруппа углерода Пищевая сода
Пищевая сода Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов
Спирты. Классификация, изомерия спиртов. Физические и химические свойства спиртов