Содержание
- 2. 2 Лекция 25 ЛЕКЦИЯ №25 Химия элементов VIIIБ-группы. I. Общая характеристика элементов VIIIБ группы. Свойства простых
- 3. 3 Лекция 25 I. Химия VIIIБ группы. Общая характеристика.
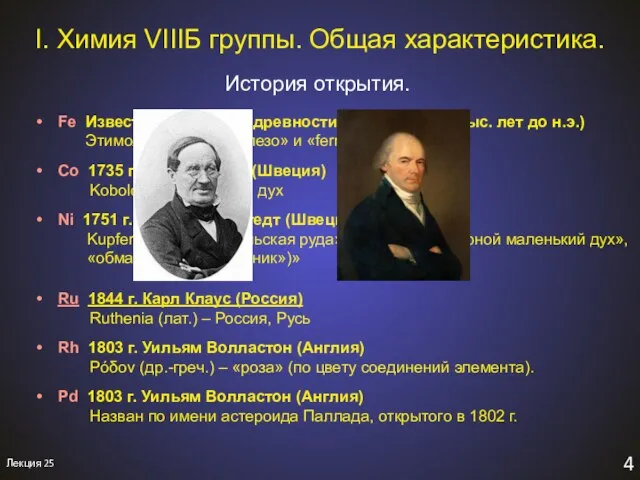
- 4. 4 Лекция 25 История открытия. I. Химия VIIIБ группы. Общая характеристика. Fe Известно с глубокой древности
- 5. 4 Лекция 25 История открытия. I. Химия VIIIБ группы. Общая характеристика. Os 1803 г. Смитсон Теннант,
- 6. 5 Лекция 25 1.1. Строение атома (валентные подуровни). Общая электронная формула: […] ns 0÷2 (n–1)d 6÷10
- 7. 6 Лекция 25 I. Химия VIIIБ группы. Общая характеристика. 1.2. Степени окисления
- 8. 7 I. Химия VIIIБ группы. Общая характеристика. 1.3. Свойства простых веществ Лекция 25 A). Физико-химические свойства
- 9. 8 I. Химия VIIIБ группы. Общая характеристика. 1.3. Свойства простых веществ Лекция 25 A). Физико-химические свойства
- 10. 9 I. Химия VIIIБ группы. Общая характеристика. 1.3. Свойства простых веществ Лекция 25 Б). Химические свойства
- 11. 10 I. Химия VIIIБ группы. Общая характеристика. 1.3. Свойства простых веществ Лекция 25 Б). Химические свойства
- 12. 11 I. Химия VIIIБ группы. Общая характеристика. 1.4. Получение. Выплавка чугуна и стали. Лекция 25 Доменный
- 13. 12 I. Химия VIIIБ группы. Общая характеристика. 1.4. Получение. Выплавка чугуна и стали. Лекция 25 Конверторный
- 14. 13 I. Химия VIIIБ группы. Общая характеристика. 1.4. Получение. Лекция 25 Очистка железа карбонильным способом пентакарбонилжелезо
- 15. II. Химия VIIIБ группы. Оксиды и гидроксиды 2.1. Оксиды и гидроксиды Э(+II) А). Получение FeSO4 +
- 16. Б). Термическое разложение II. Химия VIIIБ группы. Оксиды и гидроксиды 2.1. Оксиды и гидроксиды Э(+II) 15
- 17. II. Химия VIIIБ группы. Оксиды и гидроксиды 2.1. Оксиды и гидроксиды Э(II+) Б). Окислительно-восстановительные свойства ϕo
- 18. II. Химия VIIIБ группы. Оксиды и гидроксиды 2.1. Оксиды и гидроксиды Э(II+) Г). Кислотно-основные свойства 17
- 19. II. Химия VIIIБ группы. Оксиды и гидроксиды 2.1. Оксиды и гидроксиды Э(+III) 18 А). Получение 2Сo(OH)2
- 20. II. Химия VIIIБ группы. Оксиды и гидроксиды 2.1. Оксиды и гидроксиды Э(+III) 19 Б). Окислительные свойства
- 21. III. Химия VIIIБ группы. Катионы металлов 3.1. Протолитические свойства 20 Лекция 25 [Fe(H2O)6]2+ + H2O ⮀
- 22. III. Химия VIIIБ группы. Катионы металлов 3.2. Окислительно-восстановительные свойства 21 Лекция 25 ϕo (M3+ / M2+),
- 23. III. Химия VIIIБ группы. Катионы металлов 3.2. Окислительно-восстановительные свойства 22 Лекция 25 А). Окислительные свойства Fe3+
- 24. IV. Химия VIIIБ группы. Комплексы 4.1. Комплексные соединения железа 23 Лекция 25 А). Комплексы Fe3+ [Fe(H2O)6]3+
- 25. IV. Химия VIIIБ группы. Комплексы 4.1. Комплексные соединения кобальта и никеля 24 Лекция 25 В). Комплексы
- 26. IV. Химия VIIIБ группы. Комплексы 4.1. Комплексные соединения кобальта и никеля 25 Лекция 25 В). Комплексы
- 27. 26 Лекция 25 V. Химия VIIIБ группы. Малораствримые соедиения 5.1. Малораствримые соединения А). Сульфиды FeSO4 +
- 29. Скачать презентацию



![5 Лекция 25 1.1. Строение атома (валентные подуровни). Общая электронная формула: […]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/892551/slide-5.jpg)





















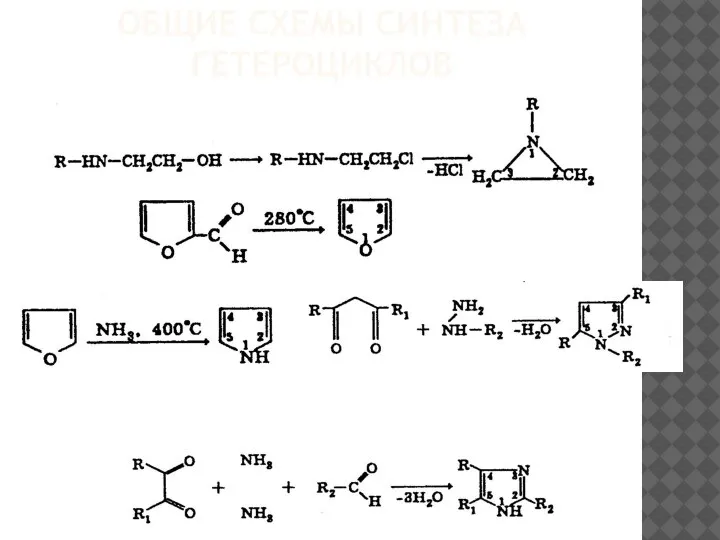 Общие схемы синтеза гетероциклов
Общие схемы синтеза гетероциклов Лекция_Химическая_кинетика_и_катализ
Лекция_Химическая_кинетика_и_катализ Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Липиды. Источники
Липиды. Источники Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Кремень. Нахождение в природе
Кремень. Нахождение в природе Основания, их классификация и свойства
Основания, их классификация и свойства Валентность. Определение валентности по формулам
Валентность. Определение валентности по формулам Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Основания. 8 класс
Основания. 8 класс Конкурс проектных работ Химический элемент … – и это все о нем
Конкурс проектных работ Химический элемент … – и это все о нем Презентация на тему Неорганическая химия: подготовка к ГИА
Презентация на тему Неорганическая химия: подготовка к ГИА  Определение химической формулы металла по экспериментальным данным
Определение химической формулы металла по экспериментальным данным Окислительно-восстановительные реакции. 8 класс
Окислительно-восстановительные реакции. 8 класс Генетические ряды углеводородов. Обобщение и систематизация знаний
Генетические ряды углеводородов. Обобщение и систематизация знаний Диэлектрики
Диэлектрики Воздух
Воздух Презентация на тему Многоатомные спирты
Презентация на тему Многоатомные спирты  Диаграмма состояния системы железо - углерод
Диаграмма состояния системы железо - углерод Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена
Исследование возможности создания порохов на основе 1,1диамино-2,2-динитроэтилена Строение атома
Строение атома Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кислородные соединения углерода
Кислородные соединения углерода Сера. Характеристика химического элемента и простого вещества
Сера. Характеристика химического элемента и простого вещества Молекулярно-механическое изнашивание
Молекулярно-механическое изнашивание Химические реакции. Классификация
Химические реакции. Классификация Фосфор - светоносный
Фосфор - светоносный