Содержание
- 2. Признаки объектов коллоидной химии
- 3. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц
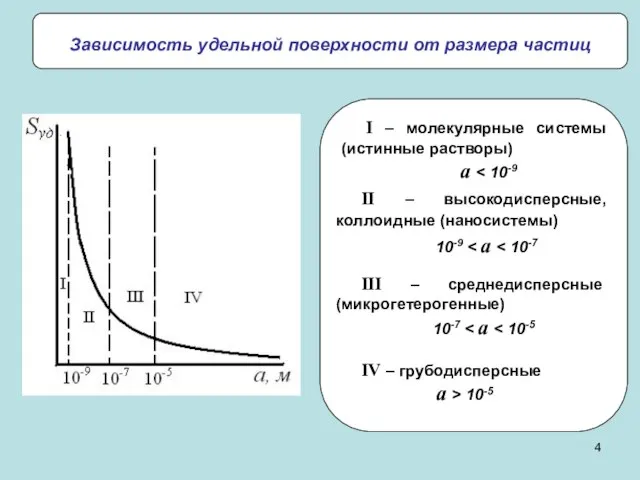
- 4. Зависимость удельной поверхности от размера частиц II – высокодисперсные, коллоидные (наносистемы) 10-9 III – среднедисперсные (микрогетерогенные)
- 5. Пример: Дисперсность частиц коллоидного золота 108 м-1. Принимая частицы золота в виде кубиков определить, какую поверхность
- 6. Особенности коллоидных систем 2. Термодинамическая неустойчивость 3. Невоспроизводимость (индивидуальность) 4. Способность к структурообразованию
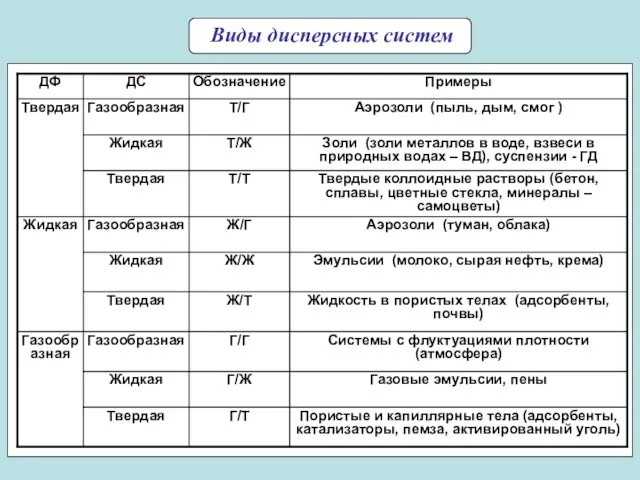
- 7. Виды дисперсных систем
- 8. Получение дисперсных систем измельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние
- 9. Для облегчения диспергирования используют понизители твердости (электролиты, эмульсии, ПАВ и др.) Понизители твердости составляют 0,1 %
- 10. основаны на ассоциации молекул в агрегаты из истинных растворов; используют для получения высокодисперсных систем; не требуют
- 11. Стадии конденсации 2. Рост зародышей. 3. Формирование слоя стабилизатора (ДЭС).
- 12. Физические конденсационные методы
- 13. Химические конденсационные методы
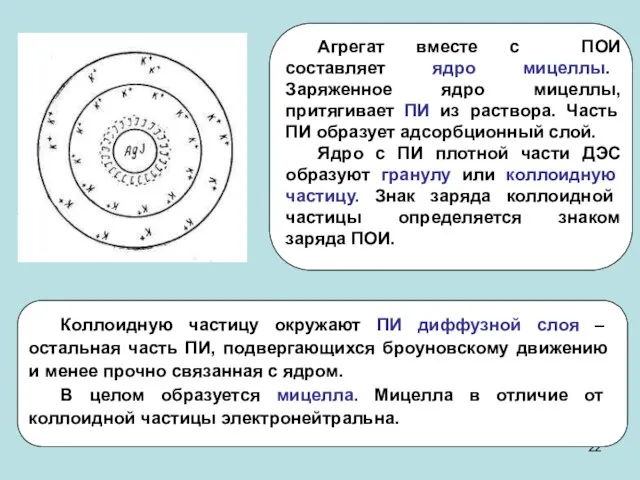
- 15. 3. Реакции окисления Образование золя серы. 2H2Sр-р + O2 = 2S ↓+ 2H2O Строение мицеллы:
- 16. 4. Реакции гидролиза Получение золя гидроксида железа. FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HCl Cтроение
- 17. Метод пептизации
- 18. Низкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью
- 19. Особенности коллоидных растворов Опалесценция (светорассеяние) наблюдается когда λ > d. Чем короче длина волны падающего света,
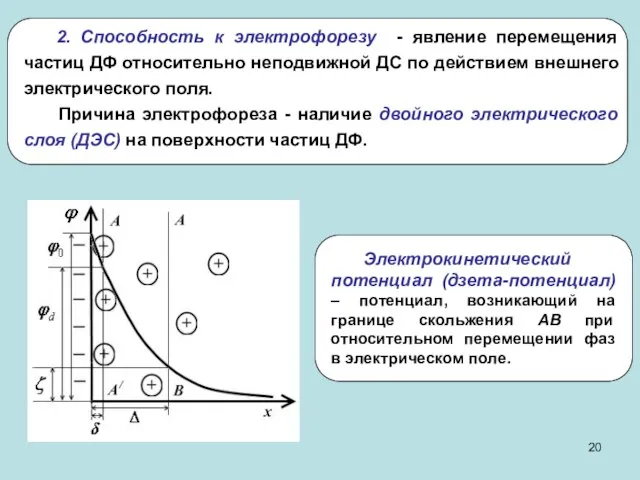
- 20. 2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического
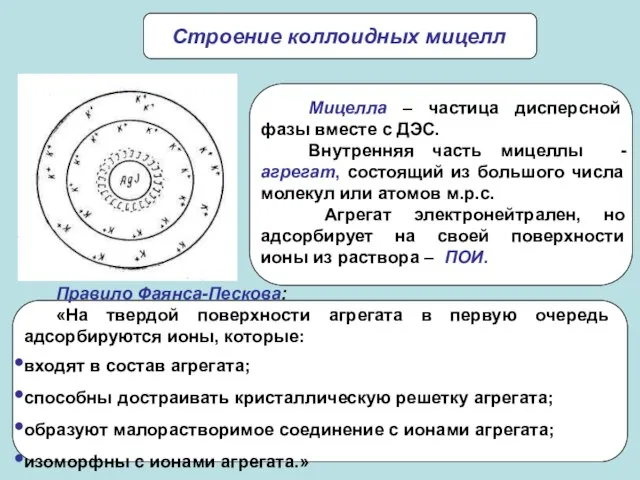
- 21. Строение коллоидных мицелл
- 23. Пример 1:
- 24. Устойчивость и коагуляция дисперсных систем
- 25. Коагуляция золей электролитами Все электролиты при определенной концентрации могут вызвать коагуляцию золя. Правило знака заряда: коагуляцию
- 26. Порог коагуляции (γ, Скр) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя Коагулирующая
- 28. Скачать презентацию




















 Химия. 8 класс
Химия. 8 класс Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք
Տերպենոիդներ (Իզոպրենոիդներ) պարունակող դեղաբույսեր եվ հումք Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена Ковалентная химическая связь
Ковалентная химическая связь Угольная кислота и ее соли
Угольная кислота и ее соли 9 урок простые и сложные вещества
9 урок простые и сложные вещества Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Распределение электронов в атоме по энергетическим уровням
Распределение электронов в атоме по энергетическим уровням Агрегатные состояния воды
Агрегатные состояния воды Основания. Классификация
Основания. Классификация Презентация на тему Химия и здоровье человека (10 класс)
Презентация на тему Химия и здоровье человека (10 класс)  Органика из аптеки
Органика из аптеки Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"
Презентация по Химии "Стиральные порошки и их экологическое воздействие на окружающую среду"  Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Как химия может помочь вам в быту?
Как химия может помочь вам в быту? Классы неорганических соединений
Классы неорганических соединений Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу
Әртүрлі заттардың кристаллдық тор энергиясын, сольваттану энергиясын, гидратация жылуын есептеу Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Кислоты. Номенклатура. Классификация
Кислоты. Номенклатура. Классификация Квантовая химия
Квантовая химия 490006
490006 Презентация на тему Сахароза
Презентация на тему Сахароза  Кислоты с металлами
Кислоты с металлами Магний (Mg, Magnesium). Общая характеристика магния
Магний (Mg, Magnesium). Общая характеристика магния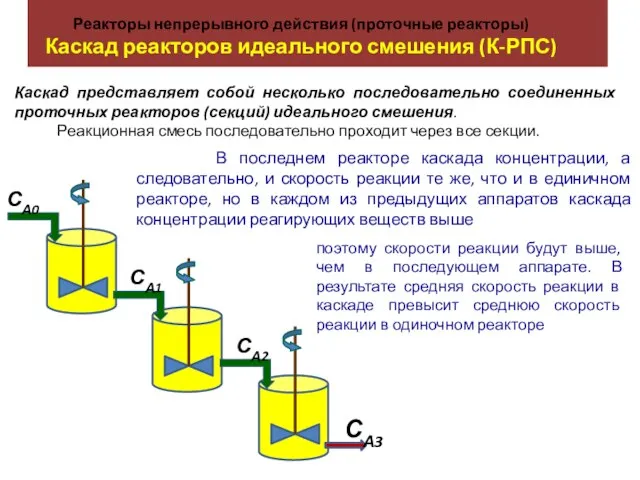 Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС)
Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС) Проектно-исследовательская деятельность обучающихся. Часть 2
Проектно-исследовательская деятельность обучающихся. Часть 2 Хлороводород и соляная кислота
Хлороводород и соляная кислота