Слайд 2Термодинамика Кинетика
Химическая реакция
Химическая реакция сопровождается разрывом одних и образованием других химических

связей, в ходе которых имеет место обмен различными видами энергии между реагирующими частицами, обмен электронами и ядрами атомов.
Поэтому реакция сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов.
Слайд 3Термодинамика Кинетика
Примеры реакций
2 Mg + O2 = 2 MgO + E (теплота,

свет)
(NH4)2Cr2O7 = Cr2O3 + N2⭡ + 4 H2O + E (теплота, работа
расширения газов)
Свинцовый аккумулятор:
(-) Анод Pb – 2e + SO42- ⭢ PbSO4
(+) Катод PbO2 + 2e + 4 H+ + SO42- ⭢ PbSO4 + 2 H2O
Pb + PbO2 + 2H2SO4 ⭢ 2PbSO4 + 2 H2O + E (Эл. ток)
Слайд 11Термодинамика Кинетика
ТЕРМОХИМИЯ
Термохимия – раздел химии, изучающий тепловые эффекты реакции.
Экзотермические реакции идут с

выделением тепла (∆Н <0).
2NaOH + H2SO4 = Na2SO4 + 2H2O + 131,4 кДж
Эндотермические реакции идут с поглощением тепла (∆Н >0).
N2 + O2 = 2NO - 180,5 кДж
Слайд 12I Закон термохимии
1789-1794 г.г.
А-Л.Лавуазье (1743-1794),
П.Лаплас

Слайд 13Термодинамика Кинетика
Тепловой эффект образования данного вещества равен по величине и обратен по

знаку тепловому эффекту реакции разложения этого вещества.
Слайд 14Термодинамика Кинетика
CaCO3(к) = CaO(к) + CO2(г) ΔН1 = 177 кДж/моль
CaO(к) + CO2(г)

= СaCO3(к) ΔН2 = -177 кДж/моль
ΔН1 = - ΔН2
Слайд 15II Закон термохимии
1840 г.
Г.И. Гесс (1802-1850)

Слайд 16Термодинамика Кинетика
Гесс Герман Иванович
Гесс Г.И. (1802-1850) – русский химик, академик Петербургской АН

(с 1830 г.)
Слайд 19Термодинамика Кинетика
2NaOH(в) + H2SO4(в) = Na2SO4(в) + 2H2O + 131,3 кДж
1)

NaOH(в) + H2SO4(в) = NaHSO4(в) + H2O + 61,7 кДж
2) NaOH(в) + NaHSO4(в) = Na2SO4(в) + H2O + 69,7 кДж
Q1 = Q2 + Q3
Слайд 20Термодинамика Кинетика
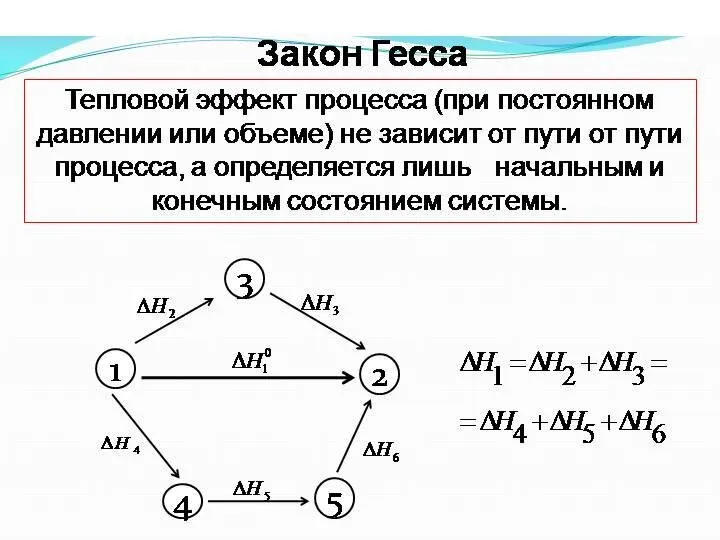
Значение законов термохимии
Расчет ΔН реакции, не проводя самой реакции

Слайд 21Термодинамика Кинетика
С(графит) + О2(г) = СО2(г) ΔН1= -393,5 кДж/моль
С(графит) + 1/2О2(г) =

СО(г) ΔН2=?
СО + 1/2О2(г) = СО2 (г) ΔН3 = -283,0 кДж/моль
ΔН1 = ΔН2 + ΔН3
ΔН2 = ΔН1 - ΔН3 = -393,5 –(-283,0) = -110,5 (кДж/моль)
Слайд 22Термодинамика Кинетика
Закон Гесса для расчета ΔН реакции
Энтальпий -
ная
диаграмма процессов окисления графита
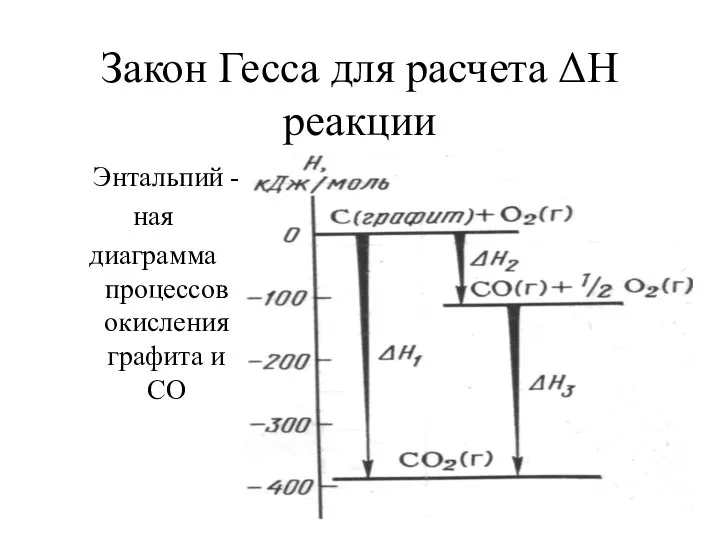
и СО
Слайд 23Термодинамика Кинетика
Энтальпию образования глюкозы нельзя определить прямым методом:
6С + 6Н2 + 3О2

= С6Н12О6 (ΔНх=?) Такая реакция невозможна
6СО2 + 6Н2О = С6Н12О6 + 6 О2 (ΔНу=?) Реакция идет в зеленых листьях, но вместе с другими процессами
Комбинируем:
С +О2 = СО2 ΔН1=-394 кДж
Н2 + ½ О2 = Н2О(пар) ΔН2=-242 кДж
С6Н12О6 + 6 О2 = 6СО2 + 6Н2О ΔН3=-2816 кДж
Тогда ΔНх= 6 ΔН1+ 6 ΔН2 - ΔН3 = 6 (-394)+ 6 (-242) –
(-2816) = -1000 кДж
Слайд 24Термодинамика Кинетика
Значение законов термохимии
Расчет энергии связи

Слайд 25Термодинамика Кинетика
Энергия связи Н-Cl
½ H2(г) = H(г) ½ ΔH1 = 215,5 кДж
½

Сl2(г) = Cl(г) ½ ΔH2 = 121,5 кДж
H(г) + Cl(г) = HCl(г) ΔH = ?
½ H2(г) + ½ Сl2(г) = HCl(г) ΔHобр = - 92 кДж
215,5 + 121,5 + ΔH = - 92
ΔH = - 431 (кДж)
Слайд 26Термодинамика Кинетика
Значение законов термохимии
Расчет энергии кристаллической решетки
Расчет теплоты растворения вещества
Расчет теплоты гидратации
Расчет

тепловых эффектов фазовых превращений
Слайд 27Термодинамика Кинетика
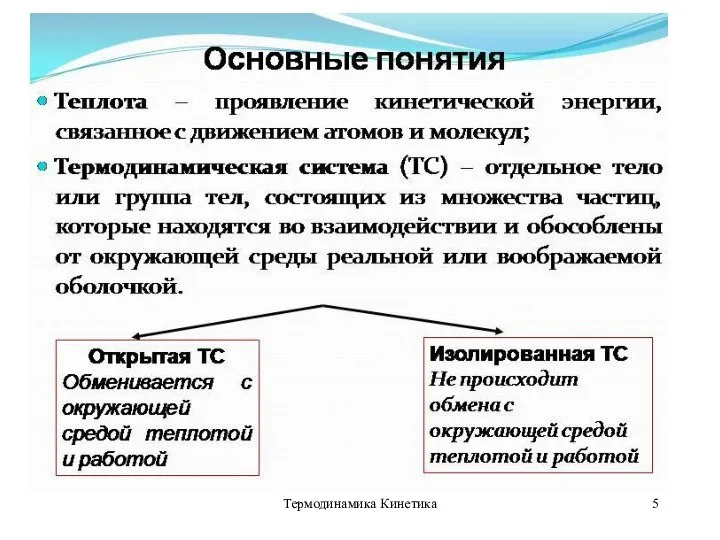
Термодинамическая система
Термодинамическая система – совокупность тел, способных энергетически взаимодействовать между собой

и с другими телами и обмениваться между собой веществом.
Слайд 28Термодинамика Кинетика
Состояние системы характеризуется давлением (Р), температурой (Т), объемом (V), массой (m),

энергией (Е).
Эти параметры позволяют рассчитать или определить экспериментально термодинамические функции системы:
1) U – внутренняя энергия системы
2) Н – энтальпия системы
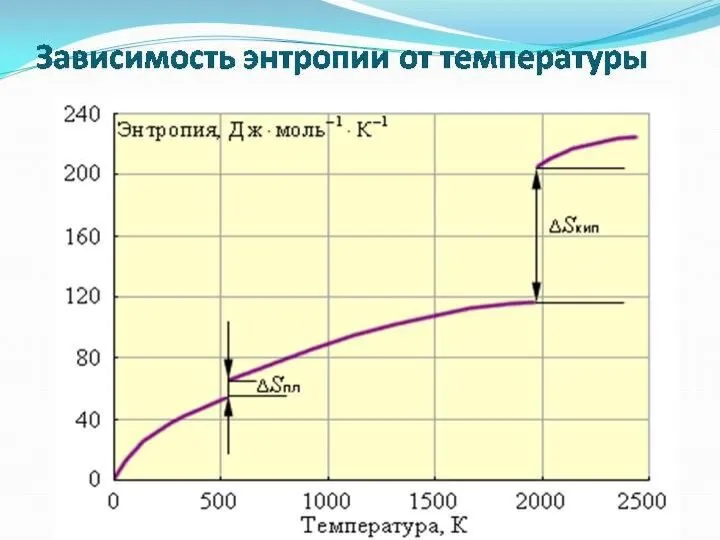
3) S – энтропия системы
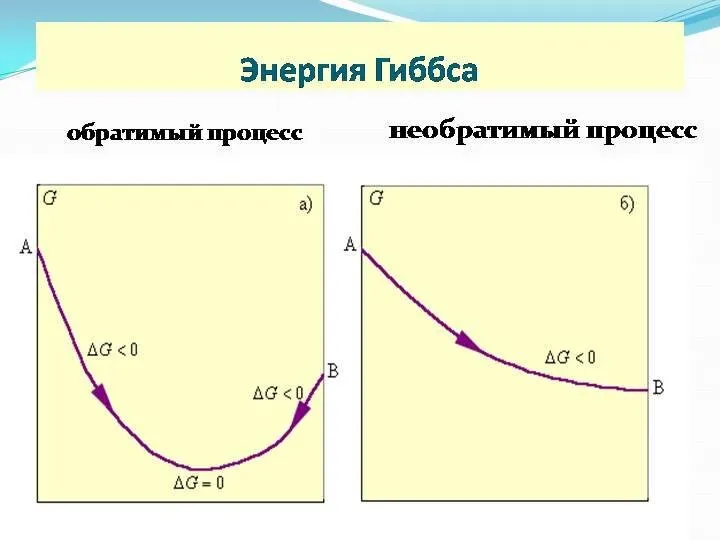
4) G – энергия Гиббса
Слайд 29Термодинамика Кинетика
1) ΔU = ΔQv – изменение внутренней энергии
2) ΔН = ΔU
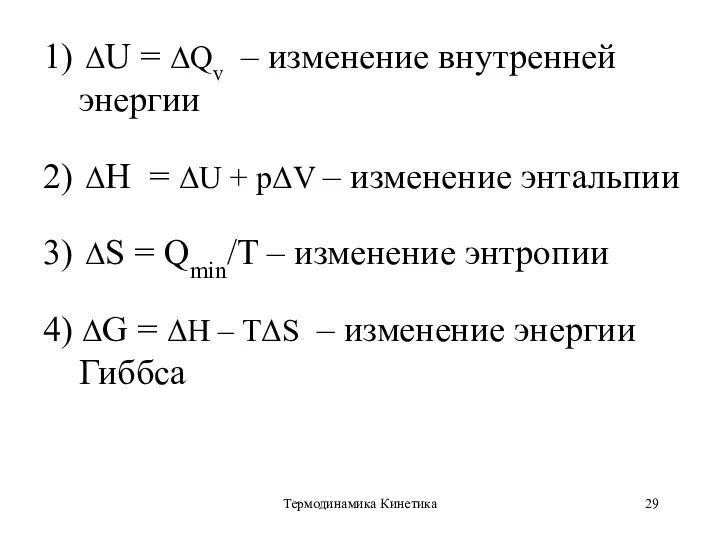
+ pΔV – изменение энтальпии
3) ΔS = Qmin/T – изменение энтропии
4) ΔG = ΔH – TΔS – изменение энергии Гиббса
Слайд 41Термодинамика Кинетика
Реакция идет самопроизвольно только при ∆G < 0 (р=const, t=const).
Cl2(г) +

2HI(г) = I2(к) + 2HCl(г) ΔGo298= -194,0 кДж/моль
Реакция идет самопроизвольно
I2(к) + H2S(г) = 2HI(г) + S(к) ΔGo298= 37,4 кДж/моль
Реакция не протекает самопроизвольно




































 Каучук
Каучук Магматические горные породы
Магматические горные породы Спирты. Методы получения
Спирты. Методы получения Дисперсные системы
Дисперсные системы Хим-1 презент
Хим-1 презент Химические формулы
Химические формулы Обобщение и повторение за курс основной школы по химии. 9 класс
Обобщение и повторение за курс основной школы по химии. 9 класс Оливины. Структура оливинов
Оливины. Структура оливинов Общая химическая технология. Определение размеров реакторов. Практическое занятие 8
Общая химическая технология. Определение размеров реакторов. Практическое занятие 8 Разбор 25 задания. Установим соответствие
Разбор 25 задания. Установим соответствие Электролиз
Электролиз Очистка рабочих электродов
Очистка рабочих электродов Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1)
Блок колонн на установке замедленного коксования производительностью 730000 тонн/год гудрона (поз.к-1, кх-1) obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Синтетические и натуральные краски
Синтетические и натуральные краски Новые грани парфюмерии. Задача 5
Новые грани парфюмерии. Задача 5 Этиленгликоль
Этиленгликоль Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Анализ образца доломита методами аналитической химии
Анализ образца доломита методами аналитической химии Диффузия и осмос
Диффузия и осмос Природные источники углеводородов. Домашняя работа. 10 класс
Природные источники углеводородов. Домашняя работа. 10 класс Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Занимательные задачи по химии
Занимательные задачи по химии Водород
Водород Ксантановая камедь
Ксантановая камедь Витамины и коферменты
Витамины и коферменты Обмен и функции нуклеотидов
Обмен и функции нуклеотидов Кальций и его соединения
Кальций и его соединения