Содержание
- 2. Правило октета Обычно химическая связь образуется за счет неспаренных электронов внешнего электронного слоя. Только инертные газы
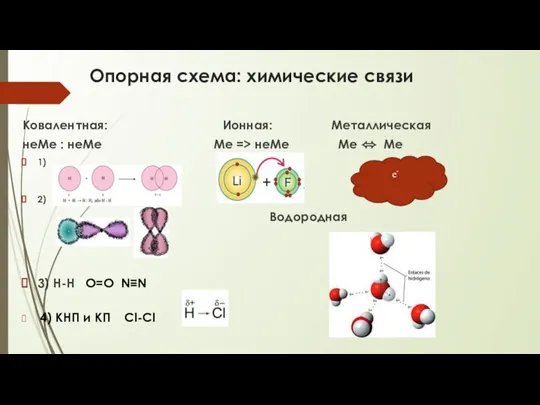
- 3. Опорная схема: химические связи Ковалентная: Ионная: Металлическая неМе : неМе Ме => неМе Ме ⬄ Ме
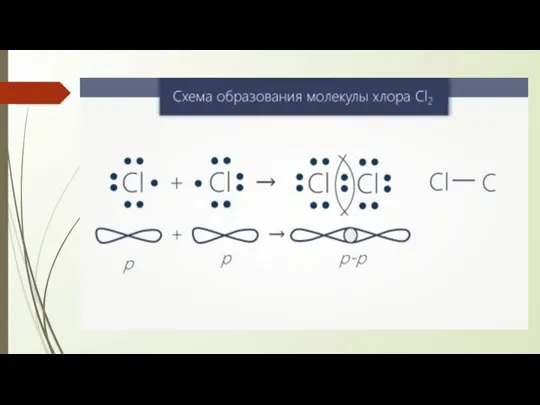
- 4. Ковалентная связь Ковалентная связь образуется между атомами неметаллов. За счет перекрывания электронных облаков между ядрами двух
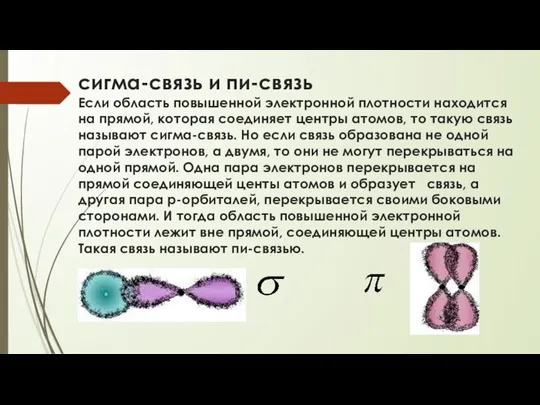
- 6. сигма-связь и пи-связь Если область повышенной электронной плотности находится на прямой, которая соединяет центры атомов, то
- 7. одинарные и кратные связи Связь, образованная одной парой электронов, называется одинарной. Это всегда связь Н-Н или
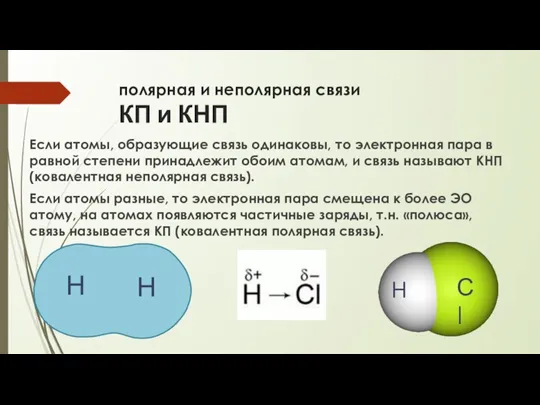
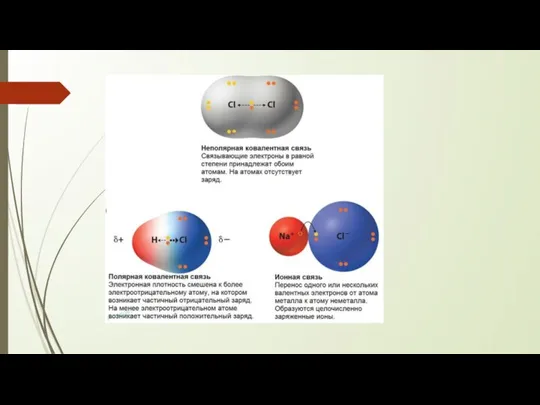
- 8. полярная и неполярная связи КП и КНП Если атомы, образующие связь одинаковы, то электронная пара в
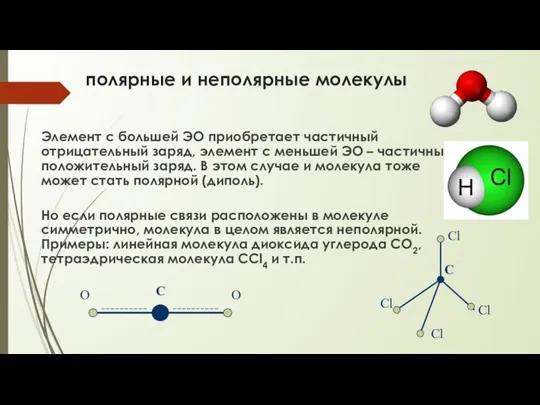
- 9. полярные и неполярные молекулы Элемент с большей ЭО приобретает частичный отрицательный заряд, элемент с меньшей ЭО
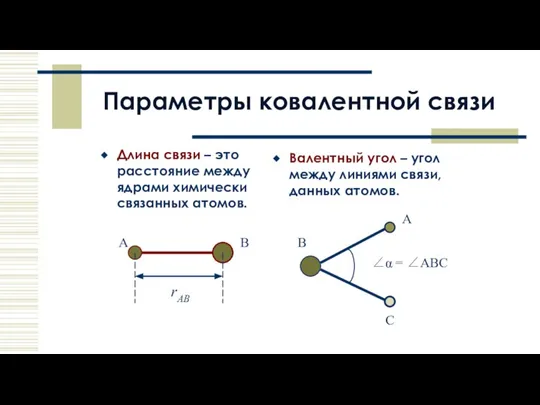
- 10. Параметры ковалентной связи Длина связи – это расстояние между ядрами химически связанных атомов. Валентный угол –
- 11. Энергия ковалентной связи E(AB) – это энергия, необходимая для того, чтобы разорвать связь между атомами A
- 12. Какая ковалентная связь более прочная? 1. или ? 2. одинарная или двойная? 3. полярная или неполярная?
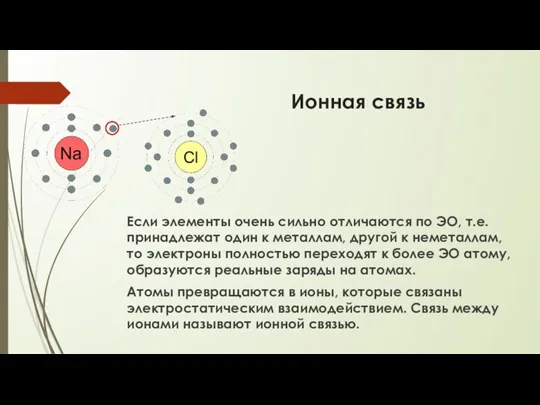
- 13. Ионная связь Если элементы очень сильно отличаются по ЭО, т.е. принадлежат один к металлам, другой к
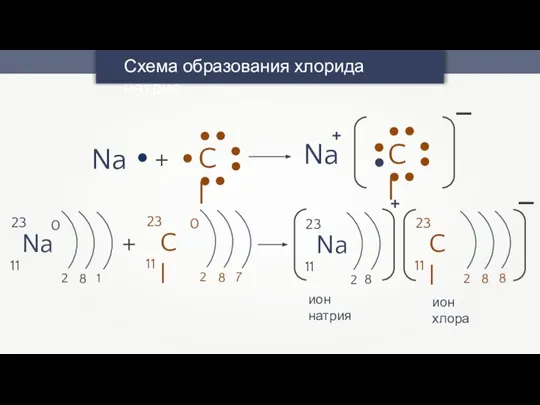
- 14. Схема образования хлорида натрия Na + Cl Na + Cl - 0 11 23 + 0
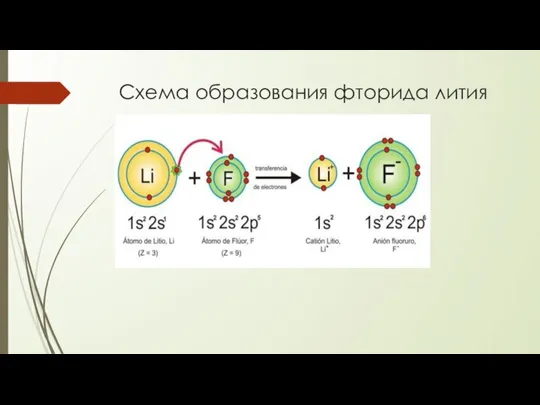
- 15. Схема образования фторида лития
- 16. Свойства ионной связи. Ионная связь – это «суперполярная» связь. Ионная связь менее прочная чем ковалентная. Ионная
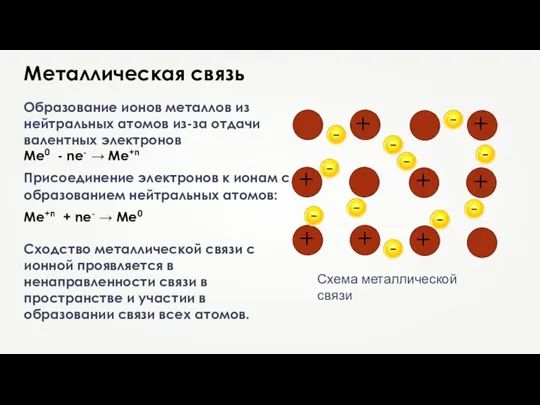
- 18. металлическая связь Особенности атомов металлов: — на внешнем энергетическом уровне у них, как правило, находится от
- 19. + + + + + + + + Схема металлической связи Металлическая связь Образование ионов металлов
- 20. +
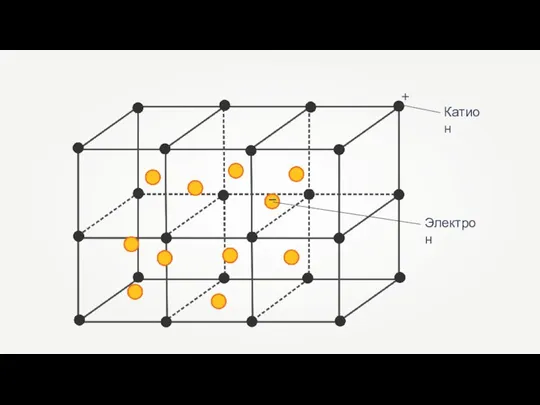
- 21. Структура металлов характеризуется металлической кристаллической решеткой, в узлах которой находятся атом-ионы Катион Электрон + -
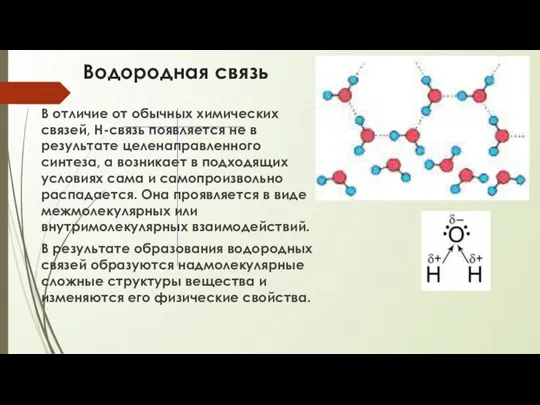
- 22. Водородная связь Водородная связь (Н-связь) – особый тип взаимодействия между атомами, при этом один из них
- 23. Водородная связь В отличие от обычных химических связей, Н-связь появляется не в результате целенаправленного синтеза, а
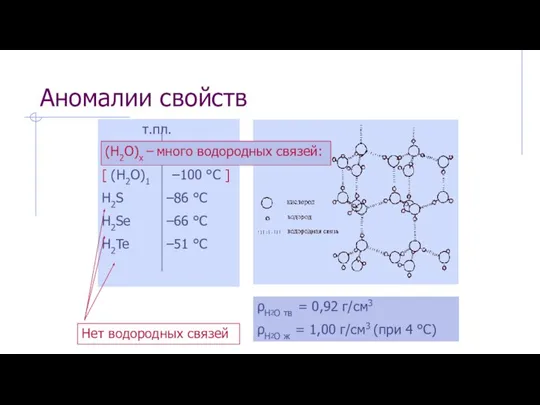
- 24. Аномалии свойств Нет водородных связей (H2O)x – много водородных связей: ρH2O тв = 0,92 г/см3 ρH2O
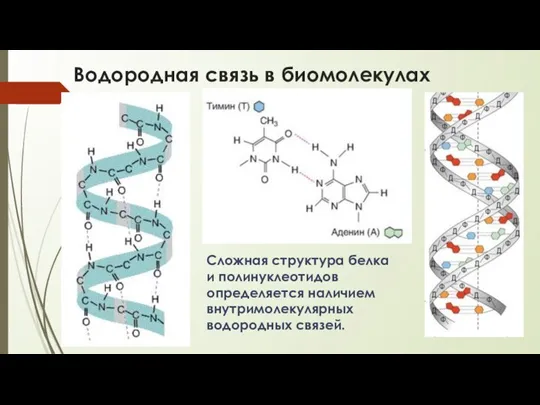
- 25. Водородная связь в биомолекулах Сложная структура белка и полинуклеотидов определяется наличием внутримолекулярных водородных связей.
- 26. Химический диктант 1. Свойства атома притягивать электроны от других атомов, называется… 2. У какого элемента э.о.
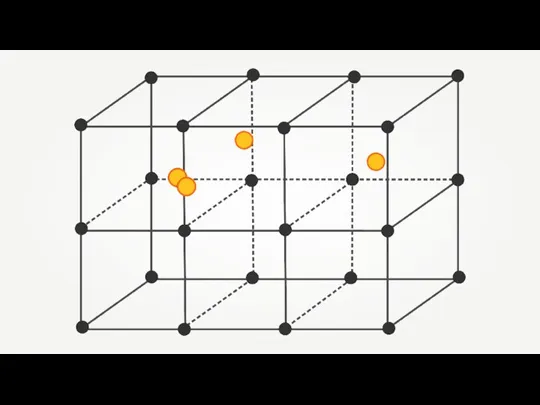
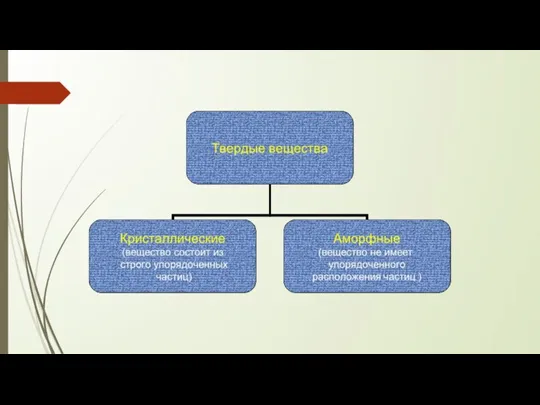
- 28. Кристаллическая решетка — пространственный каркас, образующийся в результате соединения прямыми линиями точек пространства, в которых располагаются
- 29. Определите, имеет ли вещество кристаллическое или аморфное строение Соль поваренная, смола, медный купорос, сода, воск, сахар,
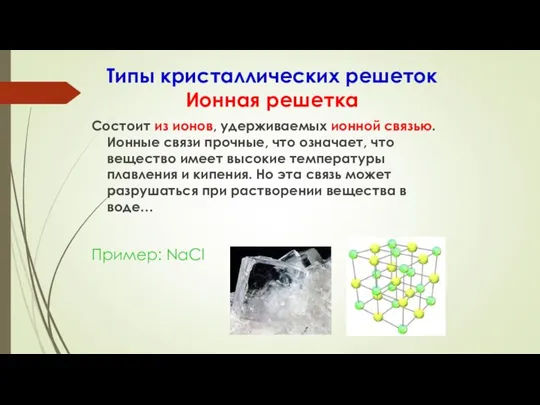
- 30. Типы кристаллических решеток Ионная решетка Состоит из ионов, удерживаемых ионной связью. Ионные связи прочные, что означает,
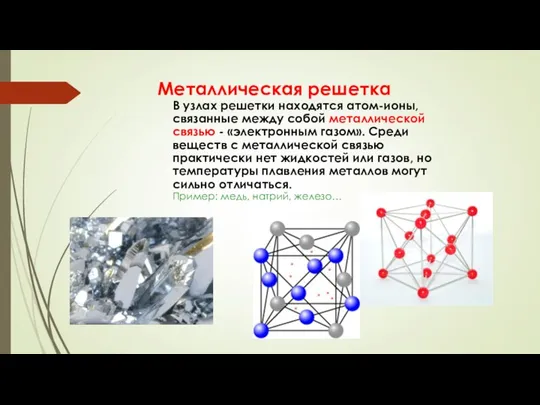
- 31. Металлическая решетка В узлах решетки находятся атом-ионы, связанные между собой металлической связью - «электронным газом». Среди
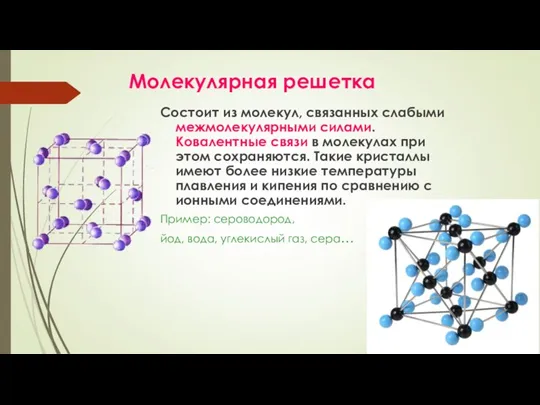
- 32. Молекулярная решетка Состоит из молекул, связанных слабыми межмолекулярными силами. Ковалентные связи в молекулах при этом сохраняются.
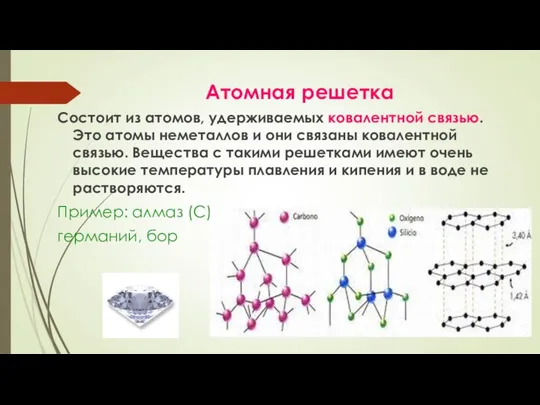
- 33. Атомная решетка Состоит из атомов, удерживаемых ковалентной связью. Это атомы неметаллов и они связаны ковалентной связью.
- 34. Выполните упражнения №1 Распределите вещества на группы, по видам химической связи: O3 , Fe2O3, Cr ,
- 36. Скачать презентацию












 Кислород. 8 класс
Кислород. 8 класс Удивительный мир металлов
Удивительный мир металлов Алифатические углеводороды
Алифатические углеводороды Типичные окислители. 9 класс
Типичные окислители. 9 класс Составы и температуры плавления смесей
Составы и температуры плавления смесей Процес сушіння тонкодисперсної пасти діоксиду титану
Процес сушіння тонкодисперсної пасти діоксиду титану Железо - основа всего мира
Железо - основа всего мира Классификация неорганических соединений
Классификация неорганических соединений Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Строение атома углерода. 10 класс
Строение атома углерода. 10 класс Стекло. Виды стекла
Стекло. Виды стекла Ліпіди і їх роль в життєдіяльності клітини
Ліпіди і їх роль в життєдіяльності клітини Презентация на тему Платина
Презентация на тему Платина  тэд — без анимации(1)
тэд — без анимации(1) Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс)
Актуализация знаний. Закон Авогадро. Молярный объем газов (8 класс) Турнир знатоков. Интеллектуальная игра
Турнир знатоков. Интеллектуальная игра Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Классификация органических соединений. Урок химии в 10 классе
Классификация органических соединений. Урок химии в 10 классе Химия природная или синтетическая. За и против
Химия природная или синтетическая. За и против Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Спирт – это жизненная необходимость или страшное зло…
Спирт – это жизненная необходимость или страшное зло… Презентация на тему Многообразие карбоновых кислот
Презентация на тему Многообразие карбоновых кислот  Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Домашняя работа по теме Фенол
Домашняя работа по теме Фенол Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4 Презентация на тему Жиры (9 класс)
Презентация на тему Жиры (9 класс)  Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Кислород
Кислород