Содержание
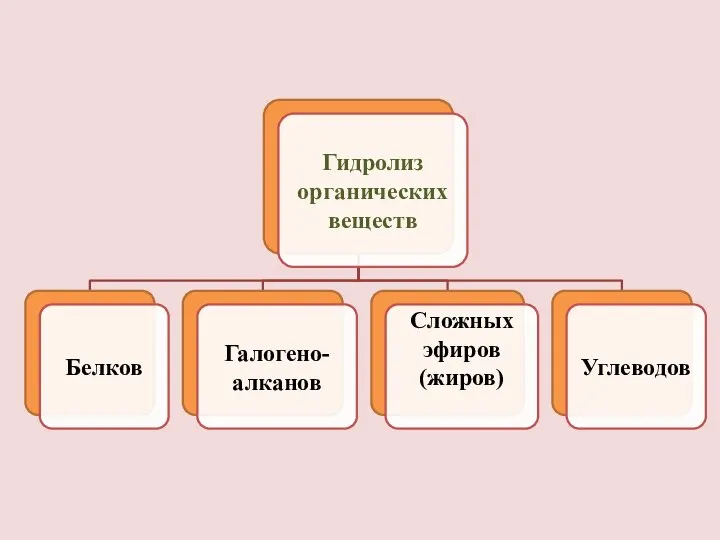
- 2. Гидролиз – это реакция обменного разложения веществ водой. Частицы растворенного вещества в воде окружены гидратной оболочкой.
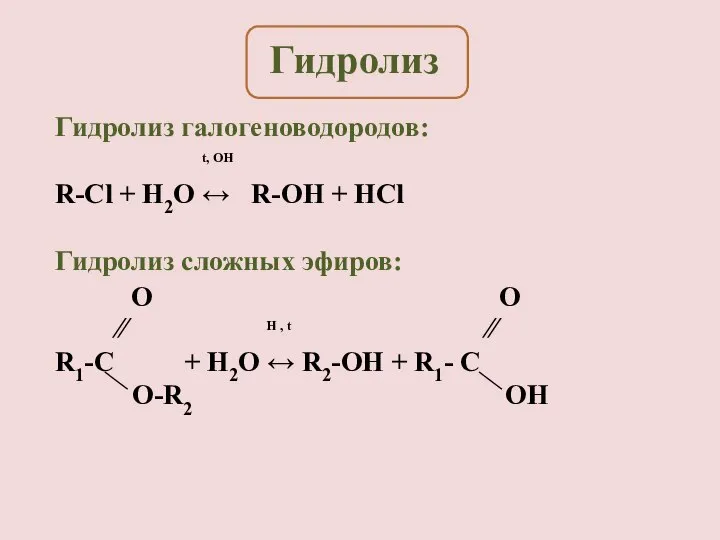
- 5. Гидролиз галогеноводородов: t, OH R-Cl + H2O ↔ R-OH + HCl Гидролиз сложных эфиров: ∕∕ H
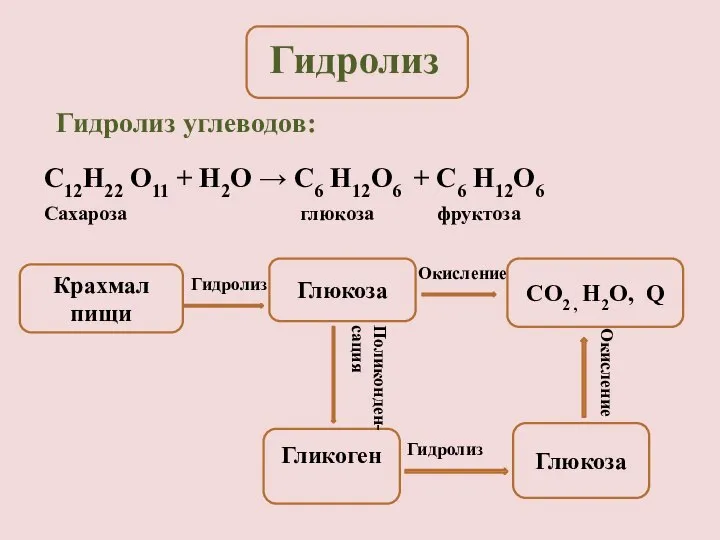
- 6. Гидролиз углеводов: Крахмал пищи Глюкоза CO2 , H2O, Q Гликоген Глюкоза Гидролиз Окисление Поликонден- сация Гидролиз
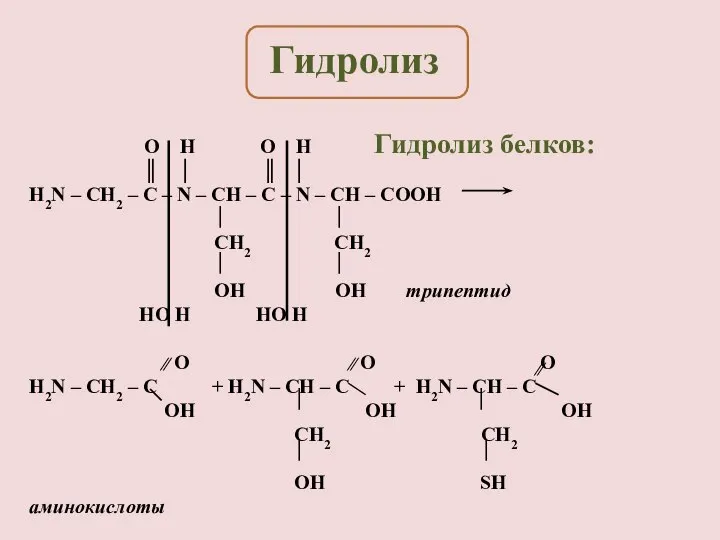
- 7. Гидролиз белков: O H O H ║ │ ║ │ H2N – CH2 – C –
- 8. Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате
- 10. Диссоциация кислот Сильные электролиты H2SO4 → 2H+ + SO42- HNO3 → H+ + NO3- HCl →
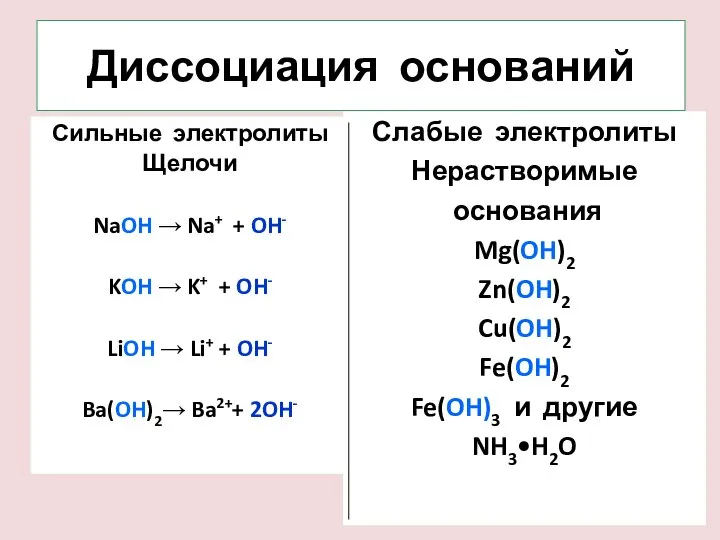
- 11. Диссоциация оснований Сильные электролиты Щелочи NaOH → Na+ + OH- KOH → K+ + OH- LiOH
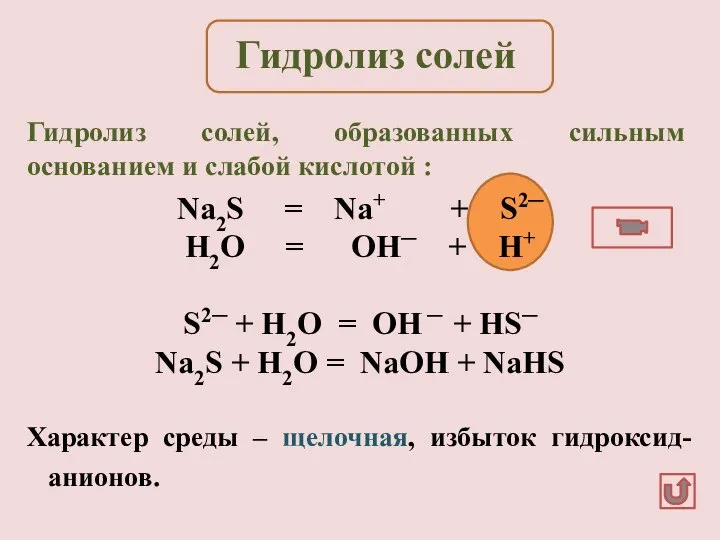
- 12. Na2S = Na+ + S2─ H2O = OH─ + H+ S2─ + H2O = OH ─
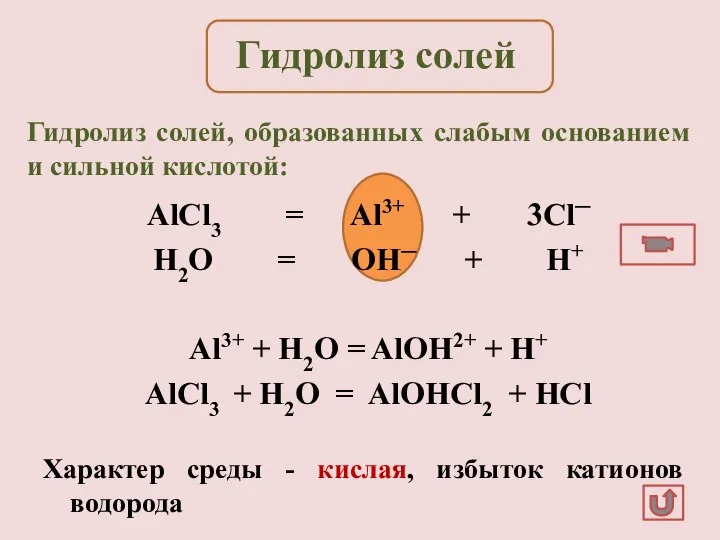
- 13. AlCl3 = Al3+ + 3Cl─ H2O = OH─ + H+ Al3+ + H2O = AlOH2+ +
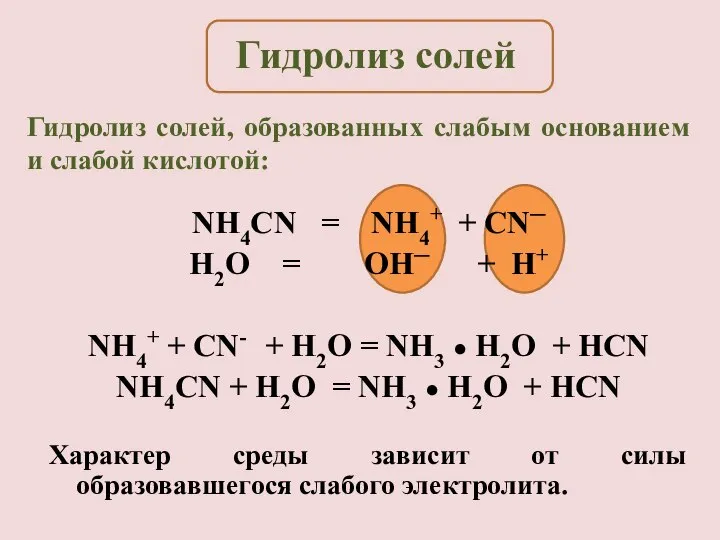
- 14. NH4CN = NH4+ + CN─ H2O = OH─ + H+ NH4+ + CN- + H2O =
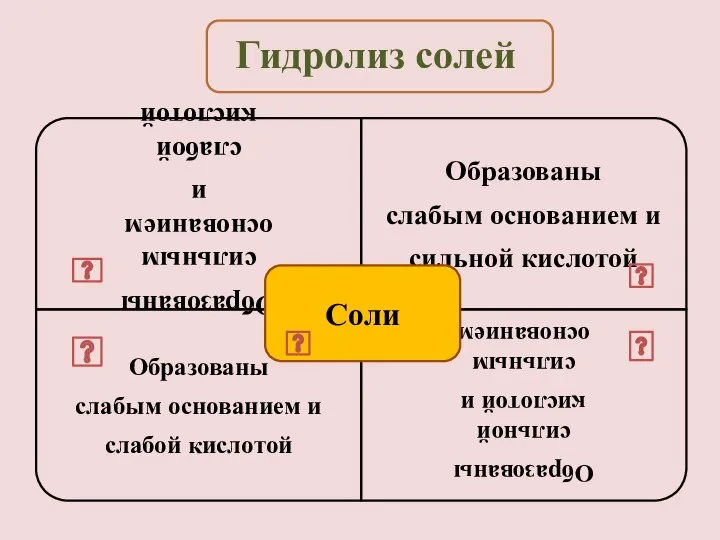
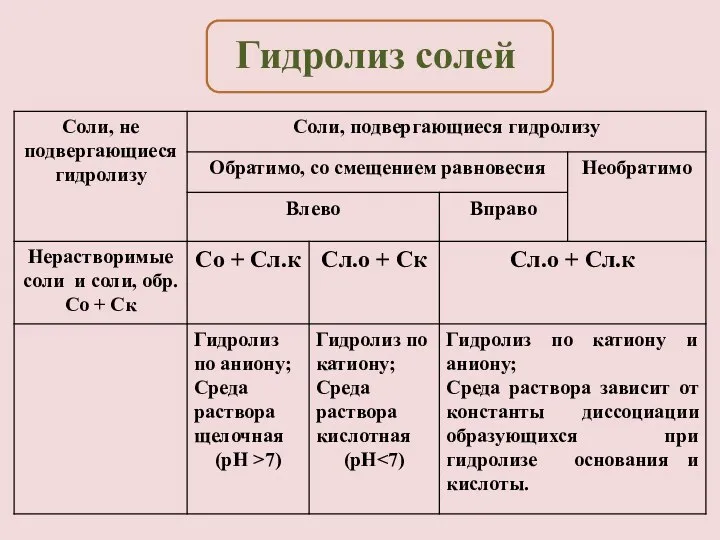
- 15. Необратимый гидролиз солей, образованных слабым основанием и слабой кислотой: Например, соли, которые нельзя получить реакцией обмена
- 16. KCl = K+ + Cl- Слабых ионов нет, гидролиз не идет, среда нейтральная. Гидролиз солей, образованных
- 18. Условия смещения реакций обратимого гидролиза (согласно принципу Ле Шателье). Усилить гидролиз соли можно следующими способами: Добавить
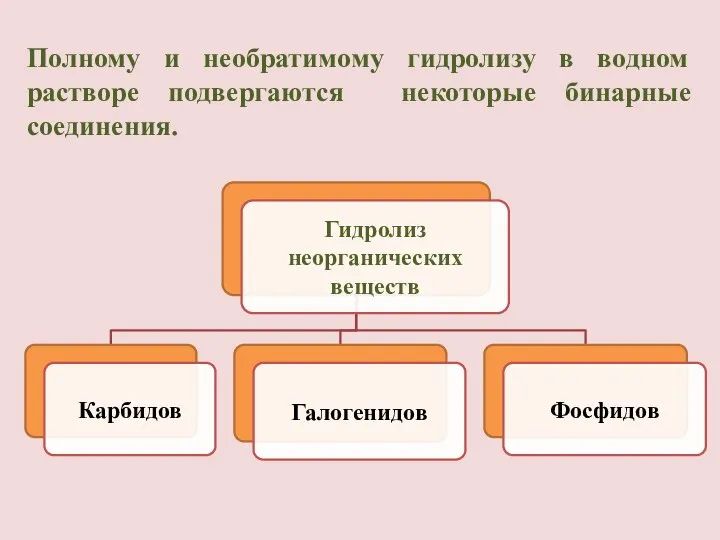
- 19. Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения.
- 20. Гидролиз карбидов: CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбид ацетилен кальция Al4C3 + 12H2O
- 21. Гидролиз галогенидов: SiCl4 + 3H2O = H2SiO4↓ + 4HСl хлорид кремниевая кремния (+4) кислота Гидролиз фосфидов:
- 22. Роль гидролиза: В природе: преобразование земной коры; обеспечение слабощелочной среды морской воды. В народном хозяйстве: порча
- 24. Скачать презентацию










 Особенности строения алкенов
Особенности строения алкенов Каучук. История открытия каучука
Каучук. История открытия каучука Базовые масла и присадки
Базовые масла и присадки Природные источники углеводорода
Природные источники углеводорода Нітрогеновмісні сполуки
Нітрогеновмісні сполуки Презентация по Химии "Получение уксусной кислоты и опыты с ней"
Презентация по Химии "Получение уксусной кислоты и опыты с ней"  Презентация на тему Ролевая игра "Суд над этанолом"
Презентация на тему Ролевая игра "Суд над этанолом"  Химия в игре. Проектная работа
Химия в игре. Проектная работа Пищевая сода
Пищевая сода Окисли́тельно-восстанови́тельные реа́кции
Окисли́тельно-восстанови́тельные реа́кции Презентация на тему Щелочные металлы (9 класс)
Презентация на тему Щелочные металлы (9 класс)  Презентация на тему Теория строения химических соединений А.М.Бутлерова
Презентация на тему Теория строения химических соединений А.М.Бутлерова  Основы химической термодинамики
Основы химической термодинамики Серная кислота
Серная кислота Основания. Классификация оснований
Основания. Классификация оснований Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Молярный объем газов. Закон Авогадро
Молярный объем газов. Закон Авогадро Получение волокон на основе сверхвысокомолекулярного полиэтилена
Получение волокон на основе сверхвысокомолекулярного полиэтилена Реакции ионного обмена составление ионных уравнений
Реакции ионного обмена составление ионных уравнений Кинетика гомогенных реакций
Кинетика гомогенных реакций Вода. Классы неорганических соединений. 8 класс
Вода. Классы неорганических соединений. 8 класс Введение в биохимию
Введение в биохимию Эксергетический баланс
Эксергетический баланс Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений
Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений Кроссворд. Плотность
Кроссворд. Плотность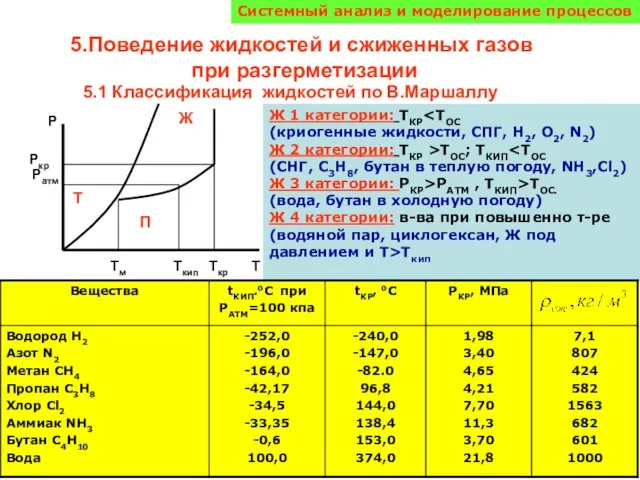 Поведение жидкостей и сжиженных газов при разгерметизации
Поведение жидкостей и сжиженных газов при разгерметизации Ароматические углеводороды
Ароматические углеводороды Тривиальные названия
Тривиальные названия