Содержание
- 2. Простые вещества металлы и неметаллы
- 3. Что известно о металлах? Известно 95 элементов Большой атомный радиус Отдают внешние электроны (1 – 3)
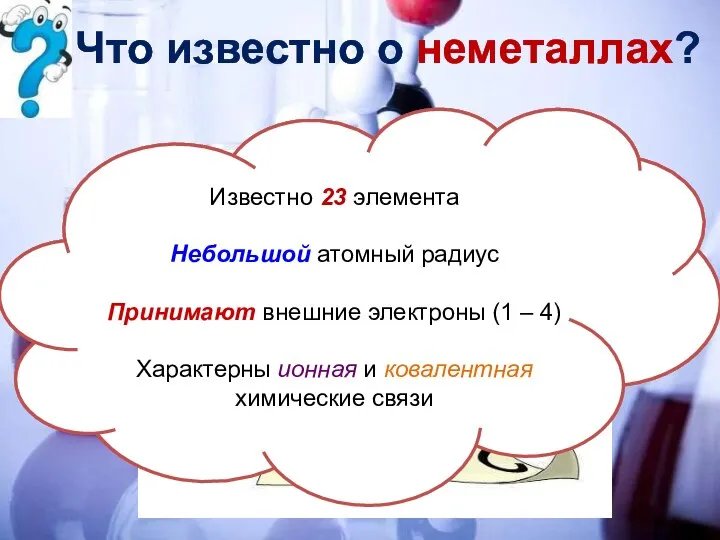
- 4. Что известно о неметаллах? Известно 23 элемента Небольшой атомный радиус Принимают внешние электроны (1 – 4)
- 5. Ме неМе (95) (23) Rат Rат ˃ Отдают внешние e̅ Принимают внешние e̅ 1 – 3
- 6. Физические свойства металлов
- 7. 1. Агрегатное состояние Твердые (все Ме, кроме Hg) Жидкая (Hg – ртуть)
- 8. 2. Температура плавления Тугоплавкие (tпл > 1000°С) W – вольфрам Легкоплавкие (tпл Hg – ртуть
- 9. 3. Твёрдость Твердые (Cr – хром) Мягкие (Щелочные металлы)
- 10. 4. Плотность Тяжелые (ρ > 5 г/см3) Pb, Hg, Cd Легкие (ρ Al, Li, Mg
- 11. Электропроводность металлов объясняется наличием в их структуре общих свободных электронов 5. Электропроводность Худшая (Hg, Pb, W)
- 12. 6. Теплопроводность Объясняется наличием свободных электронов, которые в результате своего движения обеспечивают быстрое выравнивание температуры металла.
- 13. Объясняется смещением слоев атомов без разрыва химических связей. 7. Ковкость, пластичность, прочность
- 14. Обеспечивается отражающей способностью свободных электронов. 8. Металлический блеск
- 15. Физические свойства неметаллов
- 16. 1. Агрегатное состояние Твердые (C, P, S) Жидкий (Br2) Газы (O2, H2, N2, Cl2, F2, O3)
- 17. 2. Сыпучие, не твёрдые
- 18. 3. Не тепло- и не электропроводные (искл.-С)
- 19. 3. Малая плотность(искл.-С)
- 20. Это способность атомов одного и того же х.э. образовывать несколько простых веществ (аллотропных модификаций). 5. Характерна
- 21. Причины аллотропии а) разное число атомов в молекуле Р (фосфор красный) О2 (кислород) О3 (озон) Р4
- 22. Причины аллотропии б) образование разных кристаллических форм (С - углерод) Алмаз Графит Уголь
- 23. 6. Металлический блеск Характерен только для графита (С), йода (I2), кремния (Si).
- 24. Домашнее задание §14-15 прочитать, выучить определения. Составить таблицу по теме «Кристаллические решетки» по образцу (прислать в
- 26. Скачать презентацию






















 Спирты. Непредельные спирты
Спирты. Непредельные спирты Полимерные материалы и изделия
Полимерные материалы и изделия Золото. Физические свойства золота
Золото. Физические свойства золота Презентация на тему Алхимики
Презентация на тему Алхимики  Элементы формообразования (6 класс)
Элементы формообразования (6 класс) Транспорт веществ
Транспорт веществ Молекулярно-массовое распределение
Молекулярно-массовое распределение Основные понятия физической химии
Основные понятия физической химии Изомерия алкенов
Изомерия алкенов Презентация на тему Фолиевая кислота
Презентация на тему Фолиевая кислота  Основания. 8 класс
Основания. 8 класс Хлороводород и соляная кислота
Хлороводород и соляная кислота Наука ковала Победу. 1941-1945
Наука ковала Победу. 1941-1945 Первоначальные химические понятия
Первоначальные химические понятия Строение атома алюминия. Физические и химические свойства алюминия
Строение атома алюминия. Физические и химические свойства алюминия Гидролиз солей
Гидролиз солей Валентные состояния атома углерода
Валентные состояния атома углерода Периодическая система
Периодическая система Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Коррозия металла
Коррозия металла Классы неорганических веществ
Классы неорганических веществ Гідроліз солей
Гідроліз солей Презентация на тему Химия в медицине
Презентация на тему Химия в медицине  Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Химия в жизни общества
Химия в жизни общества Фотодиссоциация кислорода
Фотодиссоциация кислорода Очистка рабочих электродов
Очистка рабочих электродов Оксиды
Оксиды