Слайд 23Связь стандартного изменения энергии Гиббса реакции с константой равновесия реакции уравнением
ΔG0 =

- 2,3 R T lgKp
При подстановке значения
R=8,314 Дж/(моль•К) величина ΔG0 выразится формулой:
ΔG0= - 2,3 • 8,314T lg Кp = - 19,15 T lg Кр, Дж/моль
или ΔG0 = - 0,01915Т lg Кр, кДж/моль
При 25°С (298 К):
ΔG0298 = - 0,01915 • 298 lg К298,
или ΔG0298= - 5,71 lg К298 , кДж/моль
Слайд 24Пример:
Вычислить константу равновесия реакции:
NH3 + HC1 = NH4C1
Решение:
Из таблицы находим
ΔG°298 NH3 (—16,7

кДж/моль)
ΔG°298 HCI (—94,8 кДж/моль)
ΔG°298 NH4CI (—203,2 кДж/моль)
Слайд 25Определим ΔG°298 реакции:
ΔG°298 = - 203,2 - (-16,7 - 94,8) = -

91,7 кДж
Найденное значение ΔG°298 подставляем в уравнение ΔG0298= - 5,71 lg К298
Получаем: -91,7 = - 5,71 1g К298.
Отсюда 1g К298 = 16; т. е. К298 = 1016
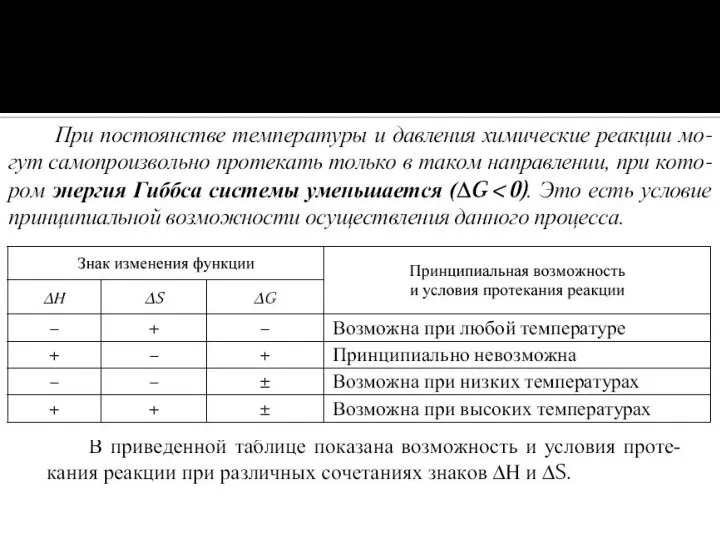
Слайд 26Большое значение найденной нами константы показывает, что при стандартной температуре равновесие
NH3 +

HC1 ↔ NH4CI
сильно смещено вправо;
иначе говоря, при стандартных условиях хлорид аммония — устойчивое соединение.
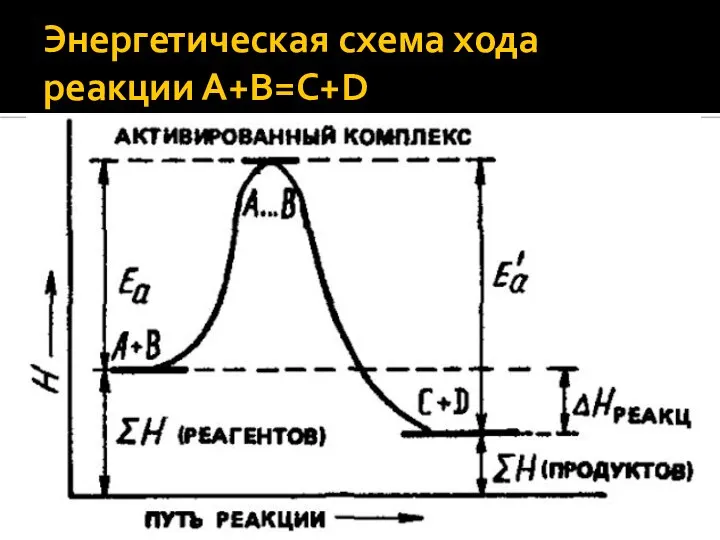
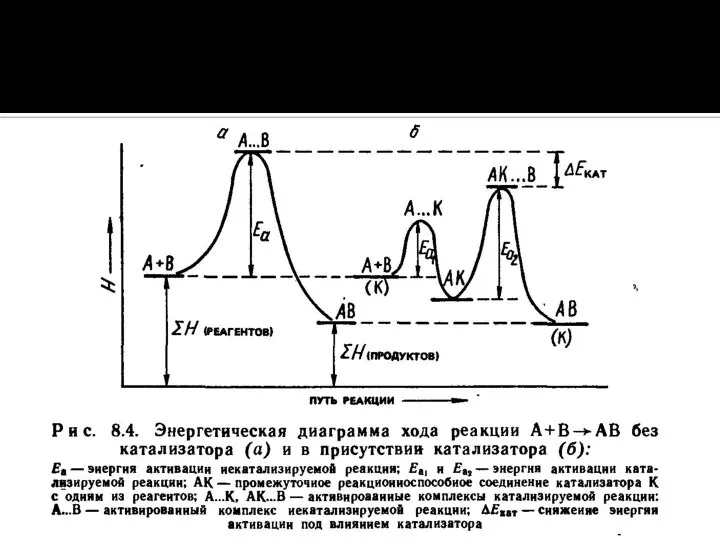
Слайд 29Энергетическая схема хода реакции А+В=С+D































 Осуществление цепочки химических превращений. Практическая работа №1
Осуществление цепочки химических превращений. Практическая работа №1 Основы химической термодинамики и термохимии. Лекция 5
Основы химической термодинамики и термохимии. Лекция 5 Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Круговорот серы в природе
Круговорот серы в природе Классификация неорганических веществ
Классификация неорганических веществ Железо и его соединения
Железо и его соединения Дизайн молекулярных магнетиков
Дизайн молекулярных магнетиков Открытый урок химии. Типы химических реакций
Открытый урок химии. Типы химических реакций Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп Особенности строения алкенов
Особенности строения алкенов Белки. Структуры белков
Белки. Структуры белков Химические реакции в органической химии
Химические реакции в органической химии План для домашней работы по теме Алкадиены
План для домашней работы по теме Алкадиены Презентация на тему Каучуки
Презентация на тему Каучуки  Степень окисления
Степень окисления Строение вещества
Строение вещества Оксиды неметаллов и металлов. Состав и названия
Оксиды неметаллов и металлов. Состав и названия 01. Химический состав
01. Химический состав Халькогены. Способность к катенации
Халькогены. Способность к катенации Виды оксидов азота
Виды оксидов азота Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік
Удосконалення процесів знешкодження рідких відходів виробництв оцтової кислоти потужністю 150 тис. т/рік Кристаллические решетки, вид связи и свойства веществ
Кристаллические решетки, вид связи и свойства веществ Электронная конфигурация атома
Электронная конфигурация атома Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Оксиды. Физические свойства
Оксиды. Физические свойства Графит. 9 класс
Графит. 9 класс Кислоты
Кислоты